אכול דבש הרבות לא טוב, וחקר כבודם כבוד. משלי כ"ה 27
בימים שבהם הגנטיקה עשתה את צעדיה המולקולריים הראשונים, קל היה, יחסית, לאמץ תפיסה שלפיה גן פגום עלול לגרום להפרעות בתיפקוד הביולוגי של הגוף, ואפילו למחלות. אבל מה קורה כאשר במטען הגנטי קיימים יותר מדי עותקים תקינים של גן מסוים? האם עודף גנים תקינים עלול לגרום תופעות שליליות? התשובה על השאלה הזאת לא הייתה ברורה, שכן עותקים רבים מדי של אותו גן לא בהכרח מביאים לייצור כמות עודפת של החלבון המקודד בגן. ובסופו של דבר, החלבונים הם השחקנים האמיתיים במגרש של התאים החיים. הגנים "רק" צופנים את המידע הנחוץ לבנייתם. בנוסף לחוסר הבהירות בשאלה זו, עמדו לנגד עיניהם של הגנטיקאים דוגמאות רבות מעולמם של הצמחים, שם ריבוי עותקים של גנים תקינים הוא תופעה רווחת (ובעלת חשיבות בהתפתחות), שאינה גורמת הפרעות כלשהן.
זה ההקשר שבו יש לראות את עבודתו החלוצית של פרופ' יורם גרונר, שהקים את המחלקה לגנטיקה מולקולרית במכון ויצמן למדע (כמיזוג של המחלקה לגנטיקה עם המחלקה לווירולוגיה), ובהמשך כיהן כמשנה לנשיא המכון. פרופ' גרונר זכה באחרונה בפרס א.מ.ת במדעי החיים - גנטיקה לשנת 2008. בנימוקי השופטים נאמר, בין היתר: "על מחקריו פורצי הדרך בביולוגיה מולקולרית של תסמונת דאון אשר הוכיחו הלכה למעשה את תיאורית מינון-גני עודף במופע של שלושה עותקים של כרומוזום 21..." .
מה היא תיאורית מינון-גני עודף? למה היה חשוב להוכיח אותה? ומתי מופיעים בתאי גוף האדם שלושה עותקים של כרומוזום 21?
בשנת 1866 תיאר הרופא האנגלי ג'ון לנגדון דאון מחלה שנקראה מאוחר יותר על שמו תסמונת דאון. לפני כ-50 שנה התברר, כי היא קשורה להופעה של שלושה עותקים של כרומוזום 21 (במקום שני עותקים הקיימים בתאים של בני-אדם רגילים). בניגוד למה שמקובל לחשוב, תסמונת דאון היא מחלה גנטית נפוצה למדי. על אף שימוש נרחב בשיטות איבחון בטרם לידה, אחד מכל 800 תינוקות הנולדים בעולם המערבי סובל מתסמונת דאון. בנוסף לפיגור השכלי-התפתחותי סובלים החולים במחלה זו משורה של פגמים, שחלקם מופיע במחלות אחרות הנפוצות באוכלוסייה הרגילה. בין היתר מדובר בליקויים בתיפקוד השרירים, סוכרת, לוקמיה, ותדירות גבוהה יחסית של מחלת אלצהיימר.
המדענים, שביקשו להבין כיצד עותק נוסף, שלישי, של כרומוזום 21 גורם תסמונת דאון, בחנו בעניין הזה שתי אפשרויות. תיאוריה אחת, שכונתה Developmental Instability, הניחה שתסמיני דאון נגרמים משיבוש שיווי המשקל הפיסיולוגי כתוצאה מהעלייה במספר הכרומוזומים. תפיסה זו התיישבה עם הדמיון הרב בין חולי תסמונת דאון ועם העובדה שרוב הפגמים שמהם הם סובלים, מופיעים גם באוכלוסייה הכללית, אם כי בתדירות וחומרה נמוכות יותר. תיאוריה אחרת, שכונתה Gene dosage effect, "מינון גני עודף", הציעה שכל אחד מהתסמינים נגרם באופן ישיר כתוצאה ממינון עודף של גן אחד או מספר גנים מהכרומוזום הנוסף, שמלווה בעליית כמות החלבון שנוצר על-ידי אותו גן.
פרופ' גרונר, בהיותו ביולוג מולקולרי, נטה לתמוך בתיאוריית "מינון גני עודף", והציב לו כמטרה להוכיח אותה. ממצאיו לא רק הוכיחו את התיאוריה, אלא גם הניחו את היסודות לחקר הגנטיקה המולקולרית של תסמונת דאון. הוא הציב לעצמו אתגר: לבודד גן אחד מסוים מכרומוזום 21, ולהוכיח שמינון עודף של אותו גן גורם לתסמינים שידועים בתסמונת דאון - ובדרך זו להוכיח את נכונותה של תיאוריית "מינון גני עודף". גישה זו הייתה באותו זמן (1979) נועזת וחדשנית. המידע בדבר הגנים שנמצאים על כרומוזום 21 היה חלקי ביותר, מבדקים מולקולריים שמאפשרים מעקב אחר ביטוי גנים לא היו בנמצא, וטכנולוגיית שיבוט גנים הייתה בחיתוליה. כמו במקרים רבים אחרים, גם במקרה הזה, כדי להגיע למחוזות ידע חדשים, היה על המדענים להמציא גלגלים חדשים. ממצאי בדיקות הראו, שבדמם של הסובלים מתסמונת דאון מצויה כמות גדולה יחסית של אנזים הקרוי SOD1. אבל האם הגן המקודד את SOD1 ממוקם על כרומוזום 21? ואם כן, מה תפקידו של SOD1 במחלה? האם עודף של האנזים הזה קשור בדרך זו או אחרת לתופעות הייחודיות לתסמונת? שאלות מסוג זה, הנשאלות היום דרך שגרה במחקרים רבים בתחום הגנטיקה, היו אז, בראשית שנות ה-80 של המאה הקודמת, כמעט מעבר להישג ידו של המדע.
אבל פרופ' גרונר וחברי קבוצת המחקר שלו לא ויתרו. הם יצאו למסע ציד אחר הגן "החשוד" שבאמצעותו קיוו להוכיח את תיאוריית "מינון גני עודף". מסע הציד (ראו תרשים) הביא לשיבוט הגן הראשון מכרומוזום 21 ולקביעת רצף הבסיסים שלו, והיווה ציון דרך חשוב בדרך להגשמת המטרה. אבל האם הגנים שיוצרים כמות עודפת של SOD1 באמת ממלאים תפקיד בגרימת הפגמים של תסמונת דאון? בשלב ראשון יצרו חברי קבוצתו של פרופ' גרונר תאים טרנסגניים עם מספר עותקים של הגן שהכילו כמות עודפת של SOD1 בדומה לתאים מחולים בתסמונת דאון. תאים טרנסגניים אלה הראו תכונות פיסיולוגיות חריגות כתוצאה מיצירת כמות עודפת של מי חמצן שהם תוצר הריאקציה של SOD1. אחד הפגמים שנבעו מכך היה פגיעה בתהליך הקליטה של מתווכים עצביים (נוירו-טרנסמיטורים), אשר באופן רגיל נקלטים ונאגרים בתוך התא. בהמשך פיענחו פרופ' גרונר וחברי קבוצתו את המנגנון המולקולרי הגורם לפגם, והראו כי מוקד הפגיעה הוא במשאבה מיוחדת שתפקידה לשאוב את המתווכים העצביים לתוך התא. ממצא זה סיפק הסבר מנגנוני מולקולרי כיצד מינון גני עודף של גן מכרומוזום 21 גורם לפגם בעל משמעות פיסיולוגית לתיפקוד התא.
אך מהו הקשר בין פגיעה זו בתהליך שאיבת המתווכים העצביים לבין תסמיני תסמונת דאון? כדי לענות על השאלה הזאת, יצאו פרופ' גרונר וחברי קבוצתו להרפתקה חלוצית נוספת. הם החדירו את הגן המקודד SOD1 לעכברים, ויצרו בפעם הראשונה מודל עכברים טרנסגניים עם גן מכרומוזום 21. עכברים אלה, שנשאו גנים של SOD1 במינון עודף ויצרו כמויות גדולות של SOD1, הכילו בדמם רמה נמוכה ביותר של המתווך העצבי סרוטונין - בדומה למה שנמצא בתינוקות הסובלים מתסמונת דאון. ממצא זה הוכיח הלכה למעשה את תיאוריית "מינון גני עודף" כמנגנון הגורם לתסמונת דאון.
אבל איך בדיוק גורם עודף של SOD1 לירידה בסרוטונין בדם? בהמשך המחקר התגלה, כי בדומה לממצאים בתאים טרנס-גניים, גם בעכברים גורם עודף SOD1 לייצור חריג של מי חמצן אשר פוגעים במשאבה המיוחדת ששואבת את הסרוטונין מהדם אל תוך תאי הטסיות, שם הוא אמור להיאגר. הכשל של מנגנון השאיבה הזה גורם לכך שהסרוטונין נשאר בזרם הדם ומתפרק. כתוצאה מכך נוצרת רמת סרוטונין נמוכה בטסיות, ובהמשך גם במוח של העכברים הטרנסגניים, בדומה למצב שמתקיים בסובלים מתסמונת דאון (תופעה דומה מתחוללת במחלת הסוכרת, שבה, כתוצאה ממחסור באינסולין, או כשל ביעילותו, הסוכר המומס בדם אינו חודר אל תוך התאים שם הוא נחוץ, אלא נשאר בזרם הדם וגורם לתופעות שליליות).
כך הושלם מעגל קלאסי של מחקר מדעי שתחילתו השערה שמנסה להסביר תופעה ביולוגית ברמת האורגניזם השלם, המשכו בזיהוי הגורם המולקולרי לתופעה, בידודו, שיחזור התופעה באופן יזום באמצעות הגורם המזוהה, וסופו פיענוח מנגנון הפעולה שבו הגורם פועל את פעולתו - והוכחת ההשערה.
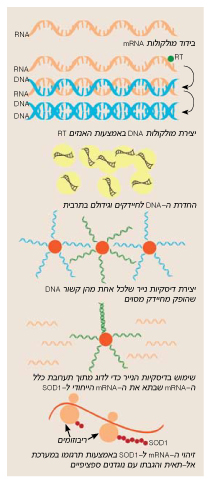
תהליך שיבוט הגן המקודד ל-SOD1
התהליך הרב-שלבי, המתואר בציור, אשר נקטו פרופ' גרונר וחברי קבוצתו כדי לשבט את הגן ל-SOD1, מבוסס על היכולת לתרגם במבחנה, במערכת אל-תאית, את ה-mRNA שמקודד ל-SOD1, ולזהות את התוצר באמצעות שימוש בנוגדנים כנגד SOD1.
בשלב הראשון לכדו המדענים מולקולות של mRNA שהיו בדרכן מגרעיני התאים אל הריבוזומים, שם הם מייצרים חלבונים שונים. בתוך כלל המולקולות היו כמובן גם כאלה שמייצרות SOD1. בעזרת האנזים RT הם שיעתקו את ה-mRNA, כלומר, "תירגמו" אותו ל-DNA. (האנזים RT, שהתגלה על-ידי דייוויד בולטימור והווארד תיימין וזיכה אותם בשנת 1975 בפרס נובל בפיסיולוגיה ורפואה, משמש נגיפים הנושאים את המטען הגנטי שלהם במולקולות RNA, כדי לשעתק את ה-RNA ל-DNA שאותו הם משלבים בכרומוזומים של התאים שהם תוקפים. כך למשל פועל הנגיף HIV שגורם לאיידס). את ה-DNA שיצרו במבחנה החדירו פרופ' גרונר וחברי קבוצתו למיליוני חיידקים, בהנחה שחלקם "יידבקו" ויתחילו לייצר עותקים רבים של DNA שמקודד ל-SOD1. למעשה, כל חיידק מייצר DNA של גן אחד מסוים שהוחדר אליו. כדי לזהות את אותם חיידקים בודדים שאכן מייצרים DNA של SOD1, הפיקו גרונר וחברי קבוצתו את ה-DNA החיידקי וקיבעו אותו על גבי דיסקיות נייר זעירות. כך נוצרה מעין "חכה" שבאמצעותה הם "דגו" את ה-mRNA שמקודד ל-SOD1 ותרגמו אותו במבחנה לחלבון. את החלבון הם זיהו באמצעות תגובה עם נוגדנים ספציפיים הנקשרים ל-SOD1. בתהליך זה הצליחו לזהות את החיידקים שהכילו את ה DNA שמקודד ל-SOD1. בידוד חיידק אחד כזה השלים את תהליך השיבוט, כלומר, היה בידי קבוצת גרונר חיידק המייצר כמויות גדולות של DNA אנושי שמקודד SOD1. עובדה זו איפשרה להם לפענח את רצף הבסיסים של הגן. כך הפך SOD1 לגן הראשון מכרומוזום 21 ששובט ורצף הבסיסים שלו נקבע.
עשרים שנה מאוחר יותר נסגר המעגל שנפתח עם השיבוט של SOD1. קבוצתו של פרופ' גרונר השתתפה במסגרת פרויקט המיפוי והפיענוח של גנום האדם בתאגיד בין-לאומי שקבע את רצף הבסיסים המלא של כרומוזום 21. פעילות זו נעשתה במסגרת מרכז הגנום ע"ש קראון בראשותו של פרופ' דורון לנצט מהמחלקה לגנטיקה מולקולרית. פרויקט גנום האדם הוא הפרויקט הגדול ביותר בתחום הביולוגיה שבוצע אי-פעם. עם סיום פרויקט הגנום הפך הצורך בשיבוט גנים למיותר. כיום, כל מדען שמעוניין לבודד גן זה או אחר וללמוד עליו ניגש למחשב, ותוך שניות מקבל את כל המידע הדרוש לו.
נער סיפון
טיול-אחרי-צבא הוא כיום מושג מוכר, שגור, וכמעט מובן מאליו. בשנות ה-06, כשיורם גרונר הצעיר סיים את תקופת השירות הסדיר בצה"ל, היה צורך ב"סיבה טובה" לנסיעה לחו"ל. וסקרנות, איך לומר, לא ממש נחשבה ל"סיבה טובה". אם לא די בזה, מחירו של כרטיס טיסה היה גבוה בהרבה מהישג יד של חייל משוחרר. מצב העניינים הזה הביא את יורם גרונר למשרדי חברת הספנות "צים", שם חתם על חוזה עבודה ועלה על אחת מאוניות המשא של החברה כנער סיפון. היעד הראשוני: מערב אפריקה. העבודה: מירוק הסיפון וקירות חדרי האחסנה וצביעתם. מלאכה סיזיפית לחלוטין. גומרים סבב אחד של כל האוניה, ומיד חוזרים לנקודת ההתחלה. הלחות והמלח גורמים בלאי מואץ, וזו הדרך היחידה למנוע שחיקה של הספינה.
לאחר אותה הפלגה שבה רכש ניסיון, התייצב במשרדי חברת "אל-ים" ונשכר, הפעם כמלח כשיר, מן המניין. בהפלגה הבאה כבר הגיע אל חופי העולם החדש, לנמל ניו-אורלינס שהפכה במשך הזמן ל"נמל הבית" שלו. את שביתת הימאים הגדולה בילה במועדוני הג'אז בעיר שאותה למד להכיר ולאהוב. אחרי שנתיים של הפלגות בציר אפריקה-אמריקה-אירופה וחוזר חלילה, מצא אונייה שבמסלול ההפלגה שלה הייתה עיר קטנה במזרח התיכון: חיפה. כאן ירד ליבשה, פנה ללימודי מדעים, והשאר, כמו שאומרים, היסטוריה.



