עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
הירשמו לניוזלטר החודשי שלנו:
בקיצור
השאלה: איך אפשר לטפל בסרטן שד, שבתאיו לא מצויים שלושת הקולטנים המשמשים כמטרות לתרופות בסוגים אחרים של סרטן זה?
הממצאים: מדעני המכון התמקדו במעבר הסרטן ממצב יציב למצב פולשני, וזיהו מעין מתג מולקולרי הממלא תפקיד מפתח בתהליך זה, אשר עשוי לשמש בעתיד כמטרה לטיפול בסרטן שד.

פרופ' סימה לב ממכון ויצמן למדע שואפת להביס סוג מאיים במיוחד של סרטן השד. כמובן, איבחון סרטן אף פעם אינו בגדר חדשות טובות, אך הסוג המסוים של גידול ממאיר בשד בו עוסקת פרופ' לב מקשה על הטיפול באופן מיוחד. סוג זה קרוי מחסור משולש (triple negative), מפני שבתאיו לא מצויים אותם שלושה קולטנים שבסוגי סרטן שד אחרים משמשים כמטרות לתרופות. באין מטרות שאליהן יכולות תרופות להיקשר, אפשרויות הטיפול מוגבלות ביותר, ואפילו כאשר הכימותרפיה אכן פועלת – הסרטן כל כך תוקפני, עד שלעיתים הוא חוזר. אפילו כאשר מתגלה הגידול בשלב מוקדם מאוד, ישנו סיכוי גדול שהוא כבר הספיק להתגנב לאיברי גוף רחוקים, ולגרום בסופו של דבר להיווצרות גרורות.
במחקר חדש, שהתפרסם בכתב-העת המדעי Nature Communications, העלו פרופ' לב והחוקרת הבתר-דוקטוריאלית ד"ר ננדיני ורמה, מהמחלקה לביולוגיה מולקולרית של התא, תובנות חדשות לגבי סרטן השד מסוג מחסור משולש, ואלה עשויות לסייע בעתיד בטיפול בגידולים ממאירים אלה. המדענים התמקדו בתהליך המתחולל בכל התאים הסרטניים על מנת ליצור גרורות. מדובר במעבר ממצב יציב יחסית, בו מנהלים התאים מגעים תקינים עם תאים שכנים ועם התבנית הבין-תאית, למצב פולשני יותר – אשר במהלכו מתארכת צורתם, אובדים המרכיבים המבניים שאיפשרו להם להתחבר לסביבה, והם מתחילים להתפשט בגוף.
המדענים זיהו מעין מתג מולקולרי –אנזים הקרוי PYK2 – אשר ממלא תפקיד מפתח במעבר למצב הפולשני. לפני כשני עשורים, כאשר גילתה פרופ' לב את האנזים הזה, היא הראתה כי הוא מעביר אותות המובילים לצמיחה, לחלוקה, ולניידות של תאים. במצב בריא, כאשר התא גדל, למשל בעובר או במהלך ריפוי פצעים, אותות אלה הם חיוניים. במחקר החדש חשפה ד"ר ורמה – בשיתוף עם עומר קינן ומיכאל סליטרניק, גם הם מקבוצתה של פרופ' לב – כיצד מעודד האנזים הזה את היווצרותן של גרורות סרטן השד.
בשלב הראשון מצאו המדענים, כי האנזים גורם להפיכת התאים לפולשניים באמצעות הארכת האות הרגיל שהוא מייצר, וזה מתחיל לפעול כמו פעמון דלת תקוע שאינו מפסיק לצלצל. בהמשך הם גילו, כי בסרטן המחסור המשולש מובילים למצב זה שני מנגנונים שונים.
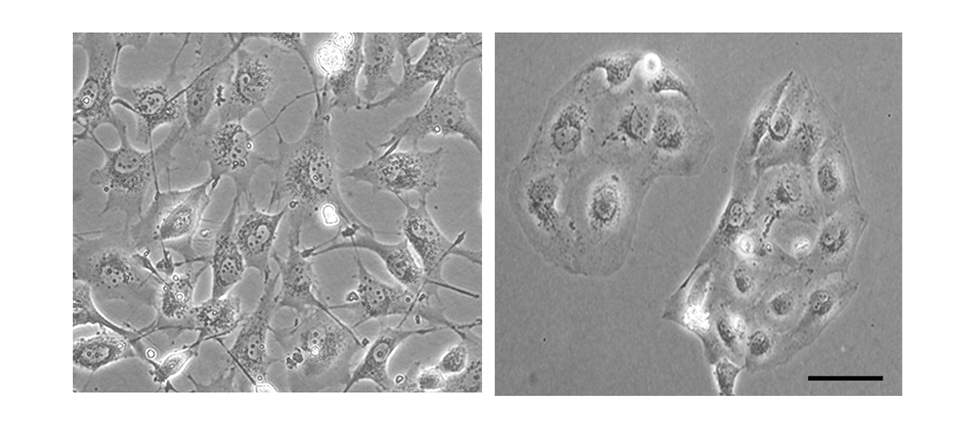
תחילה – על-ידי כך שהוא מחליש את המתג שבדרך כלל מפסיק את האות – גורם האנזים לכך שהאות המוביל למעבר למצב פולשני יישאר זמן רב במצב מופעל. במקביל פועל האנזים במעין דפוס של משוב חיובי מתמשך – הוא מעביר אות אשר מקדם את המעבר למצב פולשני, ובו בזמן מגביר את עצם ייצורו של האנזים עצמו, כך שרמתו בתא ממשיכה לעלות. שני המנגנונים האלה מובילים לכך, שהאות המוביל למעבר של התאים למצב פולשני ממשיך לפעול זמן רב, וגורם נזק רב יותר.
המדענים בדקו קרוב ל-100 דגימות רקמה מחולות סרטן שד, ומצאו שבגידולים תוקפניים יותר הייתה רמתו של האנזים גבוהה יותר. יתר על כן, בחולות שמחלתן התפשטה לכלי הלימפה הייתה רמתו של האנזים גבוהה יותר מאשר בחולים שהסרטן שלהם לא התפשט לכלים אלה. כאשר הינדסו המדענים את התאים במעבדה כדי להעלים את האנזים, חזרו התאים הפולשניים למצבם הרגיל – ראיה לכך כי אכן, האנזים הזה פועל כמתג-על המאפשר את המעבר למצב הפולשני.
לנוכח ממצאים אלה, ייתכן שהאנזים PYK2 ישמש, בעתיד, כמטרה לטיפול חדש בסרטן השד מסוג מחסור משולש, באמצעות פיתוחן של מולקולות קטנות אשר יחסמו את האות המזיק שלו. מולקולות כאלה יוכלו אולי, בעתיד, לשמש כתרופה, בשילוב עם תרופות נוספות נגד סרטן השד.
מספרי מדע |