נגיף ה-HIV, הגורם את מחלת האיידס, הוא אויב ערמומי: הוא פולש בדיוק אל התאים החיסוניים שאמורים להגן עלינו מפני זיהומים, מחליק לתוכם דווקא דרך "מערך הביצורים" שלהם, ומגייס לטובתו את מנגנוני התא כדי להשתכפל. כדי לזהות את התאים החיסוניים ולהדביק אותם, משתמש הנגיף בצברים חלבוניים המורכבים משלושה חלקים: אלה הם מבנים דמויי קוצים הממוקמים באופן אסטרטגי סביב המעטפת החיצונית של הנגיף.
ד"ר רון דיסקין, שהצטרף באחרונה למחלקה לביולוגיה מבנית במכון, מספר כי צברים חלבוניים אלה נחקרו רבות, ועם זאת, למרבה הפלא, איש עדיין לא הצליח לפענח את המבנה התלת-ממדי של צבר שלם. הסיבה לכך היא, שהחלבונים מכוסים כמעט לחלוטין במולקולות של סוכר בעלות מבנה גמיש, אשר מקשות על הגישה לחלבון. אחת המטרות הראשונות שהציב לעצמו ד"ר דיסקין במעבדתו החדשה במכון ויצמן, היא למצוא דרך לפענח את המבנה האטומי של הצברים החלבוניים דמויי הקוצים.
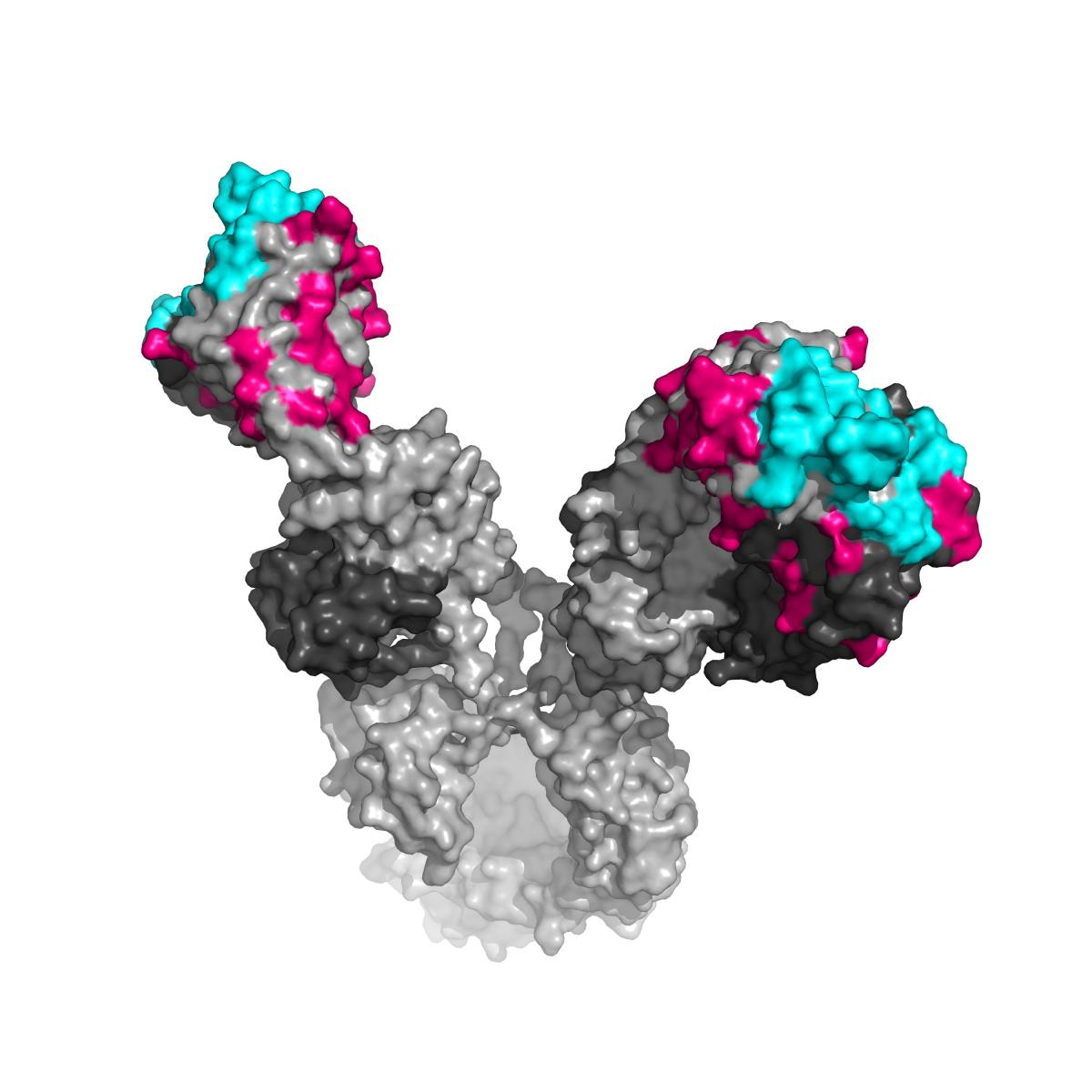
במחקרו הבתר-דוקטוריאלי במכון הטכנולוגי של קליפורניה חקר ד"ר דיסקין היבט אחר של הדבקה בנגיף האיידס: נוגדנים כנגד הנגיף אשר אנשים מסוימים מסוגלים לייצר באופן טבעי. אלה הם נוגדנים רחבי טווח המסוגלים לנטרל מיגוון רחב של נגיפי HIV, המכונים bNAbs. חלק מהאנשים שמייצרים נוגדנים כאלה לא יפתחו את מחלת האיידס, גם לאחר הדבקה בנגיף. למעשה, עצם קיומם של נוגדנים כאלה הוא תגלית מפתיעה: נגיף האיידס ידוע לשמצה בגלל יכולתו לחמוק מהמנגנונים האנטי-נגיפיים של המערכת החיסונית. הוא עושה זאת, בין היתר, באמצעות שינויים מהירים במבנה חלבוני המעטפת שלו, הנגרמים כתוצאה ממוטציות. שינויים מבניים אלה גורמים לכך, שנוגדנים המפגינים יעילות נגד צורה אחת של הנגיף יהיו חסרי תועלת נגד צורות אחרות. לעומת זאת, נוגדנים רחבי טווח תוקפים אתרים שמורים יחסית – כלומר כאלה שבהם לרוב לא מתרחשות מוטציות – על חלבוני המעטפת של הנגיף, ולכן שומרים על יעילותם כנגד טווח רחב של צורות שלובש הנגיף.
במחקר, שהתפרסם בכתב-העת המדעי Cell, בדקו ד"ר דיסקין ועמיתיו מה הופך את הנוגדנים האלה לייחודיים כל כך. הגישה שנקטו הייתה פיענוח תפקידן של המוטציות המצטברות בנוגדנים. ייצור נוגדנים מתרחש בדומה לתהליך אבולוציוני מהיר: בשלב ראשון נוצרים נוגדנים ראשוניים שבהם מיגוון גדול של מוטציות, המשפיעות על צורתם. נוגדנים אלה עוברים ברירה, אשר משאירה רק את הנוגדן שנקשר באופן הטוב ביותר לגורם המחלה. כך, כאשר המערכת החיסונית נחשפת לגורם מחלה במשך פרק זמן ממושך, היא ממשיכה לשכלל את כלי הנשק שלה. את תשומת ליבם של החוקרים משכה העובדה, שהנוגדנים האלה מכילים מספר גדול במיוחד של מוטציות ביחס לנוגדנים אחרים, וכי הם כוללים שינויים מפתיעים ברצף החלבוני במקומות לא צפויים על פני הנוגדן. בעוד שנהוג היה לחשוב כי מוטציות מתחוללות בעיקר באותם אזורים על פני הנוגדן הבאים במגע ישיר עם הפולש (שריבוי המוטציות בהם והמיגוון שלהן העניק להם את השם "אזורים משתנים"), נוגדנים רחבי טווח הכילו מוטציות גם באזורים הנחשבים "קבועים" – אלה שמעניקים לנוגדן את צורתו ואת מבנהו הכלליים.
כדי להבין את תפקידן של המוטציות הלא-רגילות, הינדסו החוקרים מחדש את הנוגדנים: הם החזירו חלק מהם למצבם הראשוני, והישוו אותם לנוגדן ה"בוגר" בעל המוטציות. ד"ר דיסקין ועמיתיו גילו, כי המוטציות באזורים הקבועים מעניקות לנוגדן יתרון משמעותי במלחמתו בנגיף האיידס. כך, לדוגמה, החלפה של חומצת אמינו יחידה באותו איזור בנוגדן שאינו נקשר לגורם המחלה, הקטינה את היציבות המבנית של הנוגדן, ובכך העניקהלו גמישות רבה יותר. החוקרים סבורים, כי גמישות זו מאפשרת לו להתאים את עצמו לצורות שונות של נגיפים.
לדברי ד"ר דיסקין, למחקר עשויות להיות השלכות יישומיות, הן לצורך פיתוח חיסון נגד איידס, והן בפיתוח אסטרטגיות חיסוניות נגד גורמי מחלות נוספים. בנוסף, הוא חושף עקרונות בסיסיים הנוגעים לאופן היווצרותם של נוגדנים. המדענים סבורים, לדוגמה, כי יצירת נוגדן יעיל, ובו קומבינציה נכונה של מספר כה גדול של מוטציות, עשויה לארוך מספר שנים. לכן, גם האנשים בני המזל, המייצרים נוגדנים רחבי טווח, יצליחו ליצור נוגדנים יעילים רק זמן ממושך לאחר שנדבקו בנגיף. בנוסף לכך, הגילוי כי מוטציות משמעותיות עשויות להיווצר גם באזורים מרוחקים מאלה בהם התמקדו מדענים עד כה, המפריך את התיאוריה המקובלת, חושף היבטים חדשים בתהליכי הייצור של נוגדנים ובאופן פעולתם, ולכן עשוי להיות רלבנטי עבור פיתוח חיסונים כנגד גורמי מחלות נוספים.
ד"ר דיסקין הוא קריסטלוגרף, כלומר, הוא חושף את המבנה התלת-ממדי של חלבונים באמצעות גיבושם לגבישים, הקרנתם בקרני רנטגן, ויצירת מודל מבני שלהם המבוסס על האופן בו הקרניים מתפזרות כשהן מוחזרות מהגביש. בנוסף לחשיפת המבנה של צברי החלבונים על מעטפת נגיף האיידס, במעבדתו שבמכון ויצמן הוא מתכנן לחקור חלבונים אחרים הבאים במגע עם נגיפים, יחסי גומלין בין חלבונים, וכן כיצד מתארגנים חלבונים בודדים ויוצרים מבנים גדולים ומורכבים.
אישי
רון דיסקין נולד וגדל בירושלים, שם, באוניברסיטה העברית, גם רכש את השכלתו המדעית: תואר ראשון ושני במדעי החיים ובביוכימיה, ותואר שלישי בביולוגיה מבנית בקבוצתו של פרופ' עודד ליבנה. לאחר מכן יצא למחקר בתר-דוקטוריאלי במכון הטכנולוגי של קליפורניה. בשנת 2012 הצטרף לסגל המחלקה לביולוגיה מבנית במכון. מילדותו נמשך לטבע, וגם אהב לפרק דברים כדי לדעת איך הם עובדים. השילוב הזה הוביל לבחירה בהתמחות בביולוגיה מבנית, אשר עוסקת במבנה המולקולות כבסיס להבנה כיצד הן פועלות.
רון דיסקין מתגורר ברחובות עם אשתו, עדי, ועם שני ילדיהם: אביגיל, בת שלוש וחצי, ואיתמר, בן שנה. את זמנו הפנוי הוא מבלה בטיולים ובחיק טבע.
 נגיף ה-HIV, הגורם את מחלת האיידס, הוא אויב ערמומי: הוא פולש בדיוק אל התאים החיסוניים שאמורים להגן עלינו מפני זיהומים, מחליק לתוכם דווקא דרך "מערך הביצורים" שלהם, ומגייס לטובתו את מנגנוני התא כדי להשתכפל. כדי לזהות את התאים החיסוניים ולהדביק אותם, משתמש הנגיף בצברים חלבוניים המורכבים משלושה חלקים: אלה הם מבנים דמויי קוצים הממוקמים באופן אסטרטגי סביב המעטפת החיצונית של הנגיף. ד"ר רון דיסקין, שהצטרף באחרונה למחלקה לביולוגיה מבנית במכון, מספר כי צברים חלבוניים אלה נחקרו רבות, ועם זאת, למרבה הפלא, איש עדיין לא הצליח לפענח את המבנה התלת-ממדי של צבר שלם. הסיבה לכך היא, שהחלבונים מכוסים כמעט לחלוטין במולקולות של סוכר בעלות מבנה גמיש, אשר מקשות על הגישה לחלבון. אחת המטרות הראשונות שהציב לעצמו ד"ר דיסקין במעבדתו החדשה במכון ויצמן, היא למצוא דרך לפענח את המבנה האטומי של הצברים החלבוניים דמויי הקוצים.
נגיף ה-HIV, הגורם את מחלת האיידס, הוא אויב ערמומי: הוא פולש בדיוק אל התאים החיסוניים שאמורים להגן עלינו מפני זיהומים, מחליק לתוכם דווקא דרך "מערך הביצורים" שלהם, ומגייס לטובתו את מנגנוני התא כדי להשתכפל. כדי לזהות את התאים החיסוניים ולהדביק אותם, משתמש הנגיף בצברים חלבוניים המורכבים משלושה חלקים: אלה הם מבנים דמויי קוצים הממוקמים באופן אסטרטגי סביב המעטפת החיצונית של הנגיף. ד"ר רון דיסקין, שהצטרף באחרונה למחלקה לביולוגיה מבנית במכון, מספר כי צברים חלבוניים אלה נחקרו רבות, ועם זאת, למרבה הפלא, איש עדיין לא הצליח לפענח את המבנה התלת-ממדי של צבר שלם. הסיבה לכך היא, שהחלבונים מכוסים כמעט לחלוטין במולקולות של סוכר בעלות מבנה גמיש, אשר מקשות על הגישה לחלבון. אחת המטרות הראשונות שהציב לעצמו ד"ר דיסקין במעבדתו החדשה במכון ויצמן, היא למצוא דרך לפענח את המבנה האטומי של הצברים החלבוניים דמויי הקוצים.