עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
הירשמו לניוזלטר החודשי שלנו:
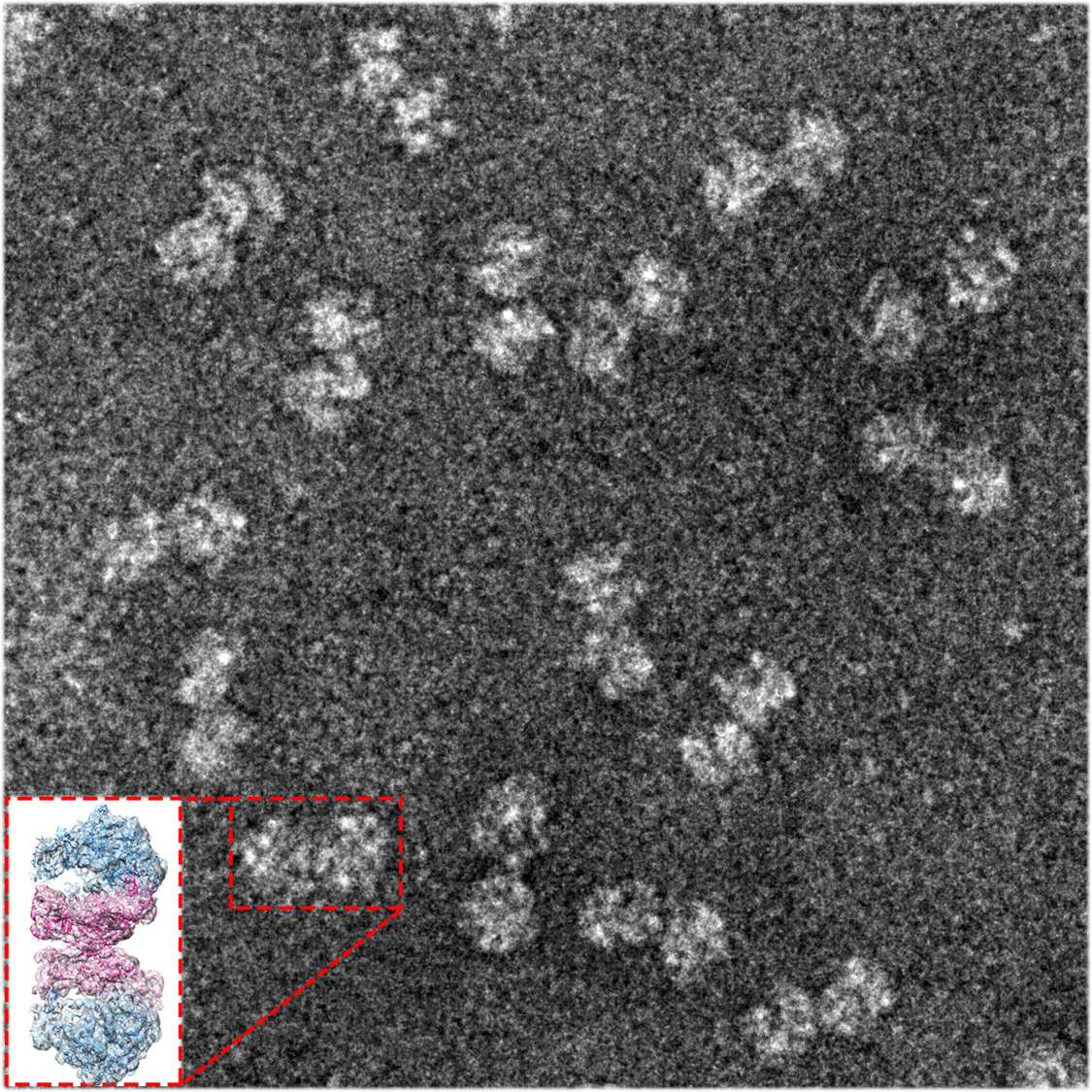
ריבוזומים – מכונות ייצור החלבונים של התא – הם שדה קרב מרכזי בלוחמה בחיידקים מזיקים. תרופות אנטיביוטיות רבות משביתות את פעילות הריבוזומים של חיידקים באמצעות היקשרות לאתרים הפעילים שלהם. פעמים רבות חיידקים מפתחים עמידות לאנטיביוטיקה באמצעות שינויים אשר מונעים מהתרופה להיקשר לריבוזום. מחקר חדש של מדעני מכון ויצמן למדע, שפורסם באחרונה בכתב-העת המדעי Nature Communications, עשוי להצביע על דרך מוכרת פחות להפוך חיידקיים לרגישים יותר לאנטיביוטיקה – באמצעות מניעת מנגנון ההשבתה הטבעית של הריבוזומים.
בתאי חיידקים, במיוחד במצבי עקה (stress), נוצרים לעיתים צמדי ריבוזומים שהתחברו זה לזה באמצעות אתרים מסוימים על גבי תת-היחידה הקטנה מבין שתי תתי-היחידות של הריבוזום. כאשר שני ריבוזומים נצמדים בדרך זו, פעילותם מושבתת והם נכנסים למצב של מעין "תרדמה". זהו מצב זמני אשר יכול להתרחש, למשל, בעקבות מחסור בחומרי מזון או לעתים אף כחלק ממנגנון הפעילות הרגיל של התא. צמדי הריבוזומים יכולים "להתעורר" מתרדמה זו בתוך שניות ולחדש את ייצור החלבונים.
כיצד מתחברים שני ריבוזומים? תהליך זה תועד בחיידק המעבדה הגראם-שלילי הנפוץ אי קולי, אך חיידקים גראם-חיוביים עשויים להשתמש במנגנונים אחרים. עם חיידקים אלו נמנה גם הסטפילוקוק הזהוב שעלול לגרום למחלות מסכנות-חיים. הבנת תהליך התרדמה בחיידקים אלה, כולל בזנים עמידים של החיידק, עשויה לספק תובנות מכריעות לפיתוח תרופות עתידיות.
כדי לענות על השאלה, פנו חוקרים מאוניברסיטת סנט לואיס, מיזורי, לקבוצת המחקר של פרופ' עדה יונת במחלקה לביולוגיה מבנית במכון ויצמן למדע בשל מומחיותה הייחודית בחשיפת המבנה התלת-ממדי המדויק של הריבוזום התורמת להבנת תיפקודו. את המחקר הובילה תלמידת המחקר דונה מצוב ממעבדתה של פרופ' יונת, שבעזרת שיטות טיהור רגישוֹת, הפרידה את הריבוזומים מהתאים, ובהמשך הפרידה את הריבוזומים המצויים בתרדמה משאר הריבוזומים הבלתי-מזווגים.
השיטה שבה השתמשנו היא מיקרוסקופיה אלקטרונית של חלקיקים בודדים בהקפאה עמוקה, שעליה הוענק השנה פרס נובל בכימיה. שיטה זו היא שאפשרה לנו להבחין בפרטים המדויקים של ריבוזומים בתרדמה"

בהמשך נערכה אנליזה מיקרוסקופית ברזולוציה גבוהה ובפירוט תלת-ממדי, בשיתוף פעולה עם קבוצת המיקרוסקופיה האלקטרונית של ד"ר אלכסיי אמונטס מאוניברסיטת שטוקהולם, שוודיה – לשם הטיסה מצוב את הריבוזומים הרדומים. אלגוריתמים ממוחשבים מתקדמים שהפעילו החוקרים על תוצרי הדימות חשפו בדיוק-רב את תפקידו של חלבון תאי לא-ריבוזומלי, הנקרא hibernating promoting factor ('גורם מקדם תרדמה', או HPF), ביצירת הקשר בין שני הריבוזומים. בחיידקים גראם-שליליים כמו אי קולי, שוכנת גרסה של חלבון זה בסמוך לאתר הפעיל בריבוזום. יחד עם חלבון נוסף הנקרא RMF, מפעיל HPF בחיידקים גראם-שליליים שרשרת אירועים אשר מובילה הן לצימוד החיצוני של שני ריבוזומים והן להפסקת ייצור החלבון בתוך האתר הפעיל של כל אחד מהריבוזומים. עם זאת, ה-RMF נעדר מחיידקים גראם-חיוביים, וחלבון ה-HPF שלהם ארוך פי שניים. "תחילה חשבנו כי HPF עשוי להיות חלבון היברידי, עם שלוחה המקבילה ל-RMF החסר", אומרת מצוב.
אולם בפועל, גילו החוקרים מנגנון שונה לחלוטין: ה-HPF של ריבוזומים רדומים בחיידקים גראם-חיוביים הוא חלבון ארוך יחסית עם שני אתרים פעילים, אחד בכל קצה, המחוברים באמצעות לולאה גמישה. במקום לחולל אפקט דומינו, הוא פועל באופן ישיר: קצה אחד מגיע אל תוך אתר ייצור החלבונים, שבו הוא חוסם את הפעילות, ואילו הקצה השני מגיע אל צידה החיצוני של תת-היחידה הקטנה, שם הוא יוצר קשר ישיר עם חלבון ה-HPF התואם בריבוזום השני. לאחר שצימוד זה מתרחש, חלקים אחרים של הריבוזומים המצומדים יכולים להתחבר לרשת תקשורת בין השניים, ובכך לסייע לשַמֵר את המבנה הריבוזומלי הזוגי ולהישאר מעודכנים בדבר שינויים שיוכלו לאפשר להם לחדש את פעילותם.
מסבירה ד"ר ענת בשן מהמעבדה של יונת: "השיטה שבה השתמשנו היא מיקרוסקופיה אלקטרונית של חלקיקים בודדים בהקפאה עמוקה (cryo-EM), שעליה הוענק השנה פרס נובל בכימיה. שיטה זו היא שאפשרה לנו להבחין בפרטים המדויקים של ריבוזומים בתרדמה. בניגוד לשיטות הקריסטלוגרפיות המסורתיות, לא נדרשנו ליצור גבישי ריבוזומים על-מנת לקבוע את המבנה, ולכן הצלחנו לחקור דגימות רבות-תצורות ודינמיות".
"הבנת תפקיד החלבון HPF עשויה להיות הצעד הראשון בפיתוח דרך למניעת תרדמה של ריבוזומים, ובכך להפוך אותם לרגישים יותר לאנטיביוטיקה", אומרת מצוב. "ומכיוון ששיטה כזו מכוונת רק לחיידקים גראם-חיוביים, חיידקים ידידותיים רבים בגופנו עשויים להימנע מפגיעה".
במחקר השתתפו גם ד"ר אלה צימרמן מקבוצת המחקר של יונת; ד"ר שינטארו אייברה מאוניברסיטת שטוקהולם; וד"ר ארנב באסו ופרופ' מי-נגן יאפ מבית הספר לרפואה של אוניברסיטת סנט לואיס.