עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
הירשמו לניוזלטר החודשי שלנו:
בשדה חרוש קשה שבעתיים לזהות תלם רענן. מעגל קרבס, או מעגל חומצת הלימון כפי שקראנו לו בשיעורי הביולוגיה בתיכון, הוא ללא ספק דוגמה לטריטוריה חרושה היטב: כבר בשנת 1953 הוענק פרס נובל להנס קרבס, הביוכימאי היהודי-גרמני שגילה אותו, ומאז נוספו חיצים רבים לתרשים האיקוני שמתאר רגע מכריע באבולוציה של החיים בכדור-הארץ: המעבר להפקת אנרגיה מבוססת חמצן. לכן, כאשר ד"ר ליה היינמן-ירושלמי ממעבדתו של פרופ' אלי זלצר במכון ויצמן למדע גילתה כי יש מקום להכניס עדכון בתרשים, היא הופתעה מעוצמת הגילוי: "מעגל קרבס מעטר כל ספר לימוד בביוכימיה, היכולת להוסיף חץ חדש לתרשים כל-כך קלאסי היא עניין מרגש ביותר".

אבל כדי לרדת לפשרו של הגילוי החדש יש לחזור תחילה לאחור. הרבה שנים לאחור. היצורים הראשונים על-פני כדור-הארץ הפיקו אנרגיה באמצעות תהליך פירוק סוכר המכונה גליקוליזה. מסלול מטבולי קדום זה אינו תלוי כלל בחמצן והוא מאפיין עד היום יצורים חיים – מחיידקים ועד בני-אדם. עם זאת, לאורך האבולוציה, ועם השתכללות החיים על-פני כדור-הארץ, התפתח גם המסלול המטבולי של מעגל קרבס המאפשר להפיק כמות אנרגיה רבה יותר וכך לתמוך בהתפתחותם ובקיומם של חיים ביולוגיים מורכבים. ואולם גם לאחר כניסתו של מעגל קרבס למשחק האבולוציוני, לגליקוליזה נותר תפקיד ביולוגי מכריע: היכולת להחליף בין מסלולים מטבוליים בעת הצורך מאפשרת לתאים להתמודד עם תנאים סביבתיים שונים מבלי לצאת מאיזון ושיווי משקל. יותר מכך, רקמות גוף או תהליכים התפתחותיים מסוימים זקוקים לתנאים דלי חמצן לצורך תפקודם התקין, ולכן נסמכים בראש ובראשונה על גליקוליזה.
""מעגל קרבס מעטר כל ספר לימוד בביוכימיה, היכולת להוסיף חץ חדש לתרשים כל-כך קלאסי היא עניין מרגש ביותר"
במעבדתו של פרופ' זלצר במחלקה לגנטיקה מולקולרית לא חוקרים בשגרה מסלולים מטבוליים, אלא את התפתחות העצמות ומערכת השלד. לפיכך התעורר העניין הראשוני שלהם בפירוק סוכרים בהקשר של תאי הסחוס – אחת מרקמות הגוף המתפתחת בתנאי מחסור בחמצן ונסמכת על הפקת אנרגיה באמצעות גליקוליזה. צוות החוקרים, בהובלת ד"ר ליטל בן טובים, ביקש להבין מדוע רקמת הסחוס "ויתרה" על אספקת חמצן ועל היתרונות האנרגטיים הטמונים בה – וכיצד משרתים אותה תנאים דלי חמצן.
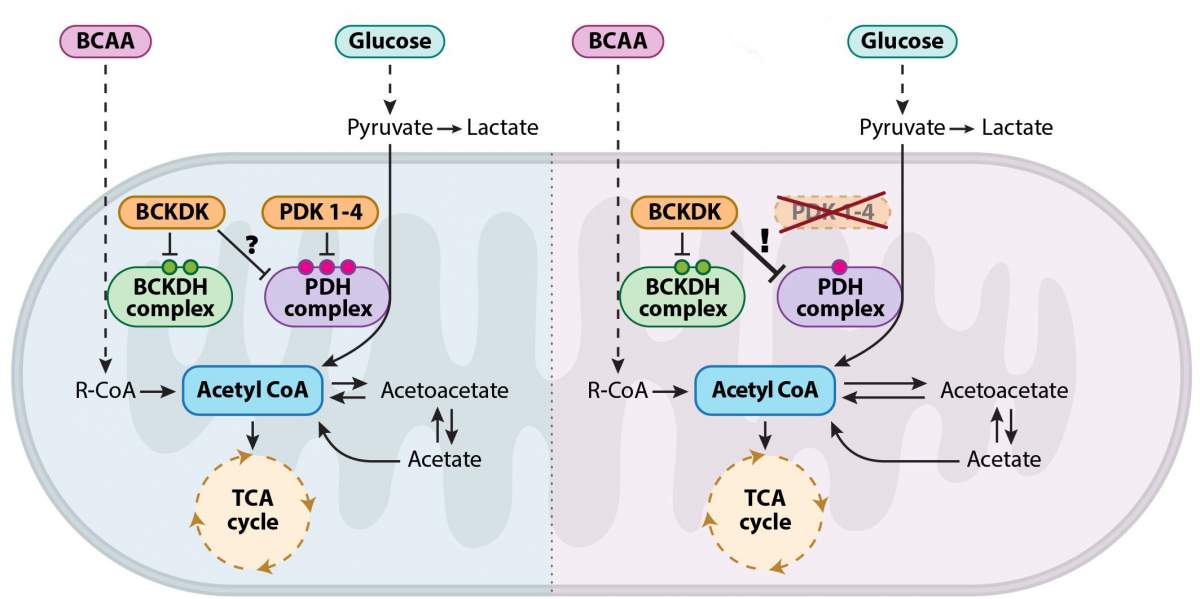
כדי לבחון שאלות אלה, ניסו החוקרים להתערב בתהליכי הנשימה התאית בעוברי עכברים, לכפות על תאי הסחוס שלהם לייצר אנרגיה באמצעות מעגל קרבס – ולראות מה קורה. לשם כך, הם פיתחו מודל גנטי של עוברי עכברים שאינם יכולים לבטא חלבוני PDK – משפחת אנזימים האחראית על ויסות המעבר בין המסלולים המטבוליים לפירוק סוכר. לתוצאות שהתקבלו איש לא ציפה: על-אף היעדרם המוחלט של אנזימי הבקרה על תהליכי הנשימה התאית, התפתחו העוברים באופן תקין לגמרי. כאשר בדקו החוקרים מה קרה בפועל, הם ראו כי אין פלא שהעוברים התפתחו כשורה – הבקרה על המעבר בין המסלולים נשמרה גם בהיעדרם של האנזימים שנחשבו עד כה לחיוניים וחסרי תחליף.
לכאורה, ככל שמדובר בחקר רקמת הסחוס, הגיע בכך המחקר למבוי סתום. עם זאת, ד"ר ליה היינמן-ירושלמי, אז תלמידת מחקר במעבדתו של פרופ' זלצר, לא יכלה להניח לממצאים המפתיעים והתעקשה לרדת לשורשם המטבולי. נחישותה זו אפשרה לצוות המחקר לגלות מנגנון לא מוכר בטריטוריה ממופה היטב: החוקרים חשפו כי במעגל קרבס מסתתרת תוכנית גיבוי לא מוכרת אשר נכנסת לפעולה בהיעדר אנזימי הבקרה ממשפחת PDK: החוקרים הראו כי לנעליהם של האנזימים החסרים נכנס אנזים בשם BCKDK, שמקורו במסלול מטבולי אחר ונפרד לכאורה – אחד המסלולים לפירוק חלבונים, או באופן ספציפי יותר, המסלול לפירוק חומצות אמינו מסועפות-שרשרת.
מעבר למדע הבסיסי פורץ הדרך, לממצאים אלה עשויה להיות השפעה על הבנה וטיפול במחלות רבות שבהן יש כשל מטבולי. ב-20 השנים האחרונות הראו מחקרים רבים שאנזימי PDK מעורבים בסרטן, במחלות מטבוליות, כגון סוכרת, ובמחלות עצבים ניווניות, כגון הנטינגטון. ממצאים אלו הביאו לפיתוח תרופות רבות ומגוונות שנועדו לעכב את פעילותם של אנזימים אלה, אך השימוש בתרופות אלו מוגבל בשל יעילות נמוכה והיעדר מודל גנטי המאפשר בדיקה פיסיולוגית מקיפה של השלכותיהן. ייתכן כי הממצאים החדשים מספקים הסבר ליעילותן הנמוכה של התרופות הקיימות ופותחים את הדלת בפני פיתוח טיפולים חדשים במחלות אלה.
יצורים הנסמכים על גליקוליזה בלבד מפיקים 2 מולקולות ATP על כל מולקולת סוכר, בעוד יצורים המשתמשים במעגל קרבס מפיקים כמות אנרגיה גבוהה פי 18 – כ-36 מולקולות ATP על כל מולקולת סוכר.