עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
הירשמו לניוזלטר החודשי שלנו:
קוראי המגזין TIME התבשרו ביולי 2017 בכתבת השער על "תקווה חדשה לדיכאון": מינון נמוך של קטמין, חומר הרדמה מוכר המשמש בחדרי ניתוח – וגם במועדונים כסם מסיבות משנה תודעה – הסתמן בשורת מחקרים כ"תרופת קסם" לסובלים ממחשבות אובדניות. שנתיים מאוחר יותר, במארס 2019, אישר מינהל המזון והתרופות האמריקאי (FDA) תרופה ראשונה לטיפול בדיכאון על בסיס קטמין – תרסיס אף של חברת ג'ונסון אנד ג'ונסון.
אף שמדובר בהתפתחות המשמעותית ביותר בתחום הטיפול בדיכאון זה עשורים, התרופה מאושרת בשלב זה לחולי דיכאון עמיד שאינם מגיבים לטיפולים אחרים. הסיבות לכך, בין היתר, הן העובדה שמדובר בתרופה חדשה שמנגנוני הפעולה שלה עדיין אינם מובנים דיים והחשש מתופעות לוואי אפשריות. במחקר חדש המתפרסם היום בכתב-העת המדעי Neuron, חושפים מדעני מכון ויצמן למדע פרטים חדשים, ברמת התא הבודד, על אופן הפעולה של קטמין ומסמנים כיוונים אפשריים לטיפול בטוח ויעיל בדיכאון.

שיעור הסובלים מדיכאון קליני מצוי בעלייה מתמדת במדינות המפותחות ובהן ישראל; שנתיים של מגיפה בינלאומית לא עזרו לשפר את הסטטיסטיקה. על-אף המספרים המדאיגים, המחיר הכלכלי והפגיעה בחיי אדם, לא נרשמה פריצת דרך משמעותית בתחום הטיפול בדיכאון כבר עשורים רבים; בוודאי לא מאז אושרה לשימוש ב-1987 התרופה נוגדת-הדיכאון המפורסמת ביותר: פרוזק. בשנים האחרונות מתרבים והולכים סימני השאלה לגבי יעילות הטיפולים הקיימים בדיכאון, אשר שליש מהחולים כלל אינם מגיבים להם.
""העמקת ההבנה של המנגנונים שבאמצעותם פועלות תרופות נוגדות-דיכאון היא אחת הדרכים להבנה טובה יותר של דיכאון – וכן לשיפור הטיפולים הקיימים"
חיסרון בולט נוסף של הטיפולים הקיימים הוא הזמן הממושך שלוקח להם להשפיע – ארבעה עד שמונה שבועות; בחולים בעלי נטיות אובדניות, המתנה שכזאת היא עניין של חיים ומוות. בדיוק מסיבה זו, כניסתם של טיפולים מבוססי קטמין נחשבת לפריצת דרך: האפקט נוגד-הדיכאון שלהם הוא מהיר במיוחד – שעות ספורות. יתרה מכך, ההשפעה נוגדת-הדיכאון נמשכת גם לאחר שהתרופה עצמה התפנתה מהגוף. במלים אחרות, אפשר לומר שתגובת הגוף לקטמין, יותר מאשר הקטמין עצמו, אחראית לאפקט נוגד-הדיכאון. אבל מהי אותה תגובה? על כך לא הייתה תשובה ברורה עד כה, וייתכן שפשוט לא חיפשו אותה בדרך המתאימה.

מחקרים קודמים שניסו לפצח את מנגנון הפעולה של קטמין, בחנו את השפעת התרופה על ביטוי גנים במוח, אך לא ברמת התא הבודד כי אם ברמת הרקמה. כאשר בודקים ביטוי גנים בדגימת רקמה הכוללת תאים מסוגים שונים, מוחקים הבדלים אפשריים בין תאים ועלולים למסך השפעות משמעותיות.
התפתחויות טכנולוגיות של השנים האחרונות מאפשרות למדענים למדוד את ביטוי הגנים ברקמה ברמת התא הבודד, וכך לאפיין ברזולוציה חסרת תקדים הבדלים בין תאים באותה הרקמה. במחקר הנוכחי, צוות מחקר במעבדתו של פרופ' אלון חן – מעבדת מחקר משותפת למכון ויצמן למדע ולמכון מקס פלאנק – בהובלת החוקר הבתר-דוקטוריאלי, ד"ר חואן פבלו לופז, השתמש בשיטות אלה כדי למפות באופן מקיף את ביטוי הגנים באלפי תאי עצב בעכברים שקיבלו מנה של קטמין.
כבר בשנות ה-90 התגלה כי בניגוד לתרופות הוותיקות הפועלות בעיקר על תאי עצב המושפעים מהמוליך העצבי סרוטונין, קטמין משפיע על תאי עצב של מערכת הגלוטמט – מוליך עצבי מרכזי אחר. עם זאת, בהתחשב בכך שההשפעה נוגדת-הדיכאון נשארת זמן רב אחרי שהתרופה מתפנה מהגוף, אי-אפשר לייחס את מנגנון הפעולה רק ליכולתו הישירה של קטמין לחסום את אחד מסוגי הקולטנים של תאי העצב לגלוטמט.
מנה בודדת של תרופה המפעילה תעלות אשלגן הספיקה כדי להגביר ולהאריך את משך ההשפעות נוגדות-הדיכאון של קטמין בעכברים. מכיוון ששתי התרופות זכו לאישור FDA, הדרך לניסויים קליניים סלולה
"רצינו להבין את תגובת השרשרת המולקולרית שמתרחשת בעקבות נטילת קטמין, מתוך הבנה שתגובה זו היא שמחוללת את האפקט ארוך הטווח", מסביר ד"ר לופז. לשם כך התמקדו החוקרים בהיפוקמפוס הקדמי – אזור שידוע ממחקרים קודמים כאתר חשוב בכל הנוגע להשפעות נוגדות-הדיכאון של קטמין.
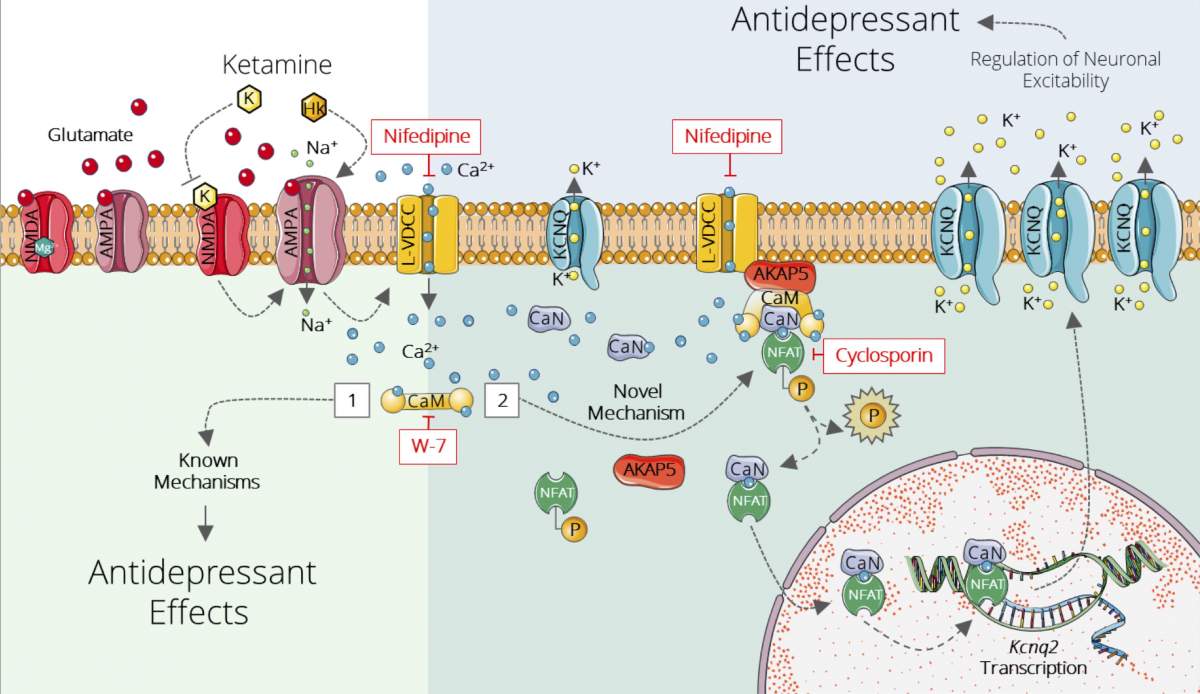
כאשר מיפו החוקרים את הביטוי הגנטי של התאים ברקמה זו בעכברים, הם גילו הבדלים בביטוי הגנטי בין תתי-אוכלוסיות של תאי עצב שנעלמו עד כה מעיניהם של מדענים. החותם הגנטי המשמעותי ביותר שהתגלה בפניהם היה בתת-אוכלוסייה של תאים שהציגו ביטוי מוגבר של Kcnq2; גן זה מקודד תעלות אשלגן, כלומר תעלות על-גבי קרום התא הנפתחות כתוצאה משינוי מתח חשמלי ומאפשרות מעבר יוני אשלגן. לתעלות אלה תפקיד מרכזי בתאי עצב, והן ידועות כמעורבות בשמירה על שיווי משקל עצבי ובלימת פעילות-יתר של התאים. באמצעות סדרת ניסויים בעכברים – ברמה המולקולרית והתאית ובאמצעות מבדקים התנהגותיים, פרמקולוגיים, תפקודיים ואלקטרופיסיולוגיים – הראו המדענים כי חותם גנטי זה אכן מעורב בהשפעה נוגדת-הדיכאון של קטמין.
בעקבות הממצאים ניסו המדענים לבדוק מה יקרה להשפעה של קטמין אם יוסיפו לו תרופה נוספת, retigabine, אשר ידועה כמפעילה של תעלות אשלגן במוח וניתנת כיום לחולי אפילפסיה. החוקרים ראו כי השילוב בין התרופות מחזק באופן משמעותי את האפקט נוגד-הדיכאון של קטמין. "מנה בודדת של retigabine הספיקה כדי להגביר ולהאריך את משך ההשפעות נוגדות-הדיכאון של קטמין בעכברים", אומר ד"ר לופז. "יתרה מכך, שילוב התרופות הוביל להשפעה דומה גם במינונים נמוכים יותר של קטמין ועשוי לאפשר להפחית תופעות לוואי בלתי-רצויות". מכיוון ששתי התרופות זכו כבר לאישור ה-FDA, הדרך סלולה לבדיקה של השפעת השילוב ביניהן על בני-אדם בניסויים קליניים.
מאות מיליוני אנשים ברחבי העולם סובלים מדיכאון, ומאות אלפים מתאבדים מדי שנה. גם לאחר עשרות שנות מחקר, הפרעה מסכנת חיים זו אינה מובנית דיה. "העמקת ההבנה של המנגנונים שבאמצעותם פועלות תרופות נוגדות-דיכאון היא אחת הדרכים להבנה טובה יותר של דיכאון – וכן לשיפור הטיפולים הקיימים", מסביר פרופ' חן שצוות המחקר בראשותו חשף מנגנון פעולה חדש של קטמין – התרופה המבטיחה ביותר כיום בתחום הטיפול בדיכאון. עם זאת, חרף ההבטחה הגדולה, השימוש בקטמין מוגבל בשל היעדר מידע מספק. ייתכן כי הממצאים החדשים יסייעו להרחיב את השימוש בטיפולים מבוססי קטמין – בין אם לבדם או בשילוב עם תרופות אחרות – ובכך להגשים באופן מלא יותר את התקווה החדשה ללוקים בדיכאון.
לפי נתוני ארגון הבריאות העולמי, כ-300 מיליון איש ברחבי העולם סובלים מדיכאון. 700,000 אנשים מתאבדים בגינו מדי שנה.