עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
הירשמו לניוזלטר החודשי שלנו:
תאי גזע עובריים מעוררים לא מעט התלהבות, ובמידה רבה של צדק – ליכולת שלהם להפוך לכל סוג רקמה יש פוטנציאל רפואי ומחקרי אדיר. ועדיין, בתחרות "התא הכל-יכול" הם לא היו מגיעים למקום הראשון. תואר זה שמור לתאים מוקדמים יותר – אלה המרכיבים את העובר ביום-יומיים הראשונים להיווצרותו. באחרונה גילו מדעני מכון ויצמן למדע כיצד מאבדים התאים המוקדמים את יכולות-העל שלהם, וחשוב לא פחות – כיצד ניתן להשיב להם אותן. "מצאנו דרך חדשה לקחת תאים הכי רחוק אחורה בזמן, לשלב הראשון בחיי העובר", אומרת ד"ר יפעת מרבל מהמחלקה לאימונולוגיה מערכתית במכון, שעמדה בראש צוות המחקר לצד פרופ' יעקוב חנא מהמחלקה לגנטיקה מולקולרית.
בשלב שבו העובר מורכב משני תאים בלבד, מאופיינים תאיו בתכונה הקרויה "טוטיפוטנציה", כלומר "יכולת לכל דבר". במלים אחרות, הם יכולים להפוך לא רק לכל סוגי התאים בעובר, אלא גם לרקמות חוץ-עובריות. אך ברגע שהתאים מתחלקים והופכים משניים לארבעה, חלקם מאבדים בהדרגה את "היכולת לכל דבר" ונאלצים להסתפק בתכונה מעט פחות מרשימה, "פלוריפוטנציה", כלומר, "יכולת לדברים רבים". אלו הם תאי הגזע העובריים המהוללים אשר יכולים לייצר כל רקמה בגוף, אך לא את השליה.

כמו החיים עצמם, תהליך התפתחות העובר מתקדם תמיד בכיוון אחד: מתא בודד, הביצית המופרית, ועד למיליארדי תאים אשר מתמקצעים בתפקידים שונים – משריר ועד עצב – ומרכיבים את גופנו. למרבה התדהמה, במעבדה ניתן להפוך את הכיוון: להחזיר תאים בוגרים למצב פלוריפוטנטי. תגלית מרעישה זו אף זיכתה את המדענים העומדים מאחוריה בפרס נובל לשנת 2012.
כעת גילו מדעני מכון ויצמן למדע מנגנון חדש, שבאמצעותו אפשר לגרום לתאים לחזור עוד יותר לאחור, כלומר להחזיר תאי גזע פלוריפוטנטיים למצב טוטיפוטנטי, זה המאפיין עובר בן יומו. למעשה, גילו החוקרים כי התא מאבד את הטוטיפוטנציה ומתחיל במסעו לגיבוש זהות עצמית מובחנת בד בבד עם הפעלתו של מנגנון המשנה את הסידור המרחבי של הכרומטין – החומר שבתוכו ארוז הדי-אן-אי.
""פתיחת הנעילה של הכרומטין וארגון מחדש של הסידור המרחבי שלו עשויים להתגלות ככלי עוצמתי לצורך הנדסת רקמות וגידול איברים להשתלה"
"מדובר במנגנון הפועל כמו סוג של מנעול, והוא אשר מבטיח שהתפתחות העובר תתקדם בכיוון אחד בלבד ולא תחזור לאחור", אומר ד"ר דאוד שיבאן, שהוביל את המחקר במסגרת לימודי הדוקטורט שלו במעבדותיהם של ד"ר מרבל ופרופ' חנא. "מנגנון הנעילה הזה דוחס פיסית את הכרומטין, כלומר משנה את הסידור המרחבי שלו, ובכך מונע את התבטאותם של גנים המזוהים עם טוטיפוטנציה. ברגע שמבטלים את הדחיסה, הכרומטין נפתח והנעילה משתחררת".
ניסויים בעכברים חשפו מה בדיוק גורם לכרומטין לשנות את צורתו ולעבור דחיסה. זה קורה כאשר לאחת מאבני הבניין של הכרומטין, חלבון הקרוי היסטון 1H, מוצמד חלבון אחר ממשפחת SUMO (ראשי תיבות של small ubiquitin-like modifiers). בניגוד לבן דודו המפורסם, אוביקוויטין, ה-SUMO אינו מסמן חלבונים לפירוק אלא משנה את פעילותם. סימון זה הינו אחד מתוך שורה ארוכה של סימונים המשנים את פעילותם של חלבונים לאחר שכבר נוצרו. "שינויים מאוחרים אלה הם למעשה מנגנון בקרה בעל השפעה מכרעת על פעילותן של מולקולות חיוניות אלה", מסבירה ד"ר מרבל.
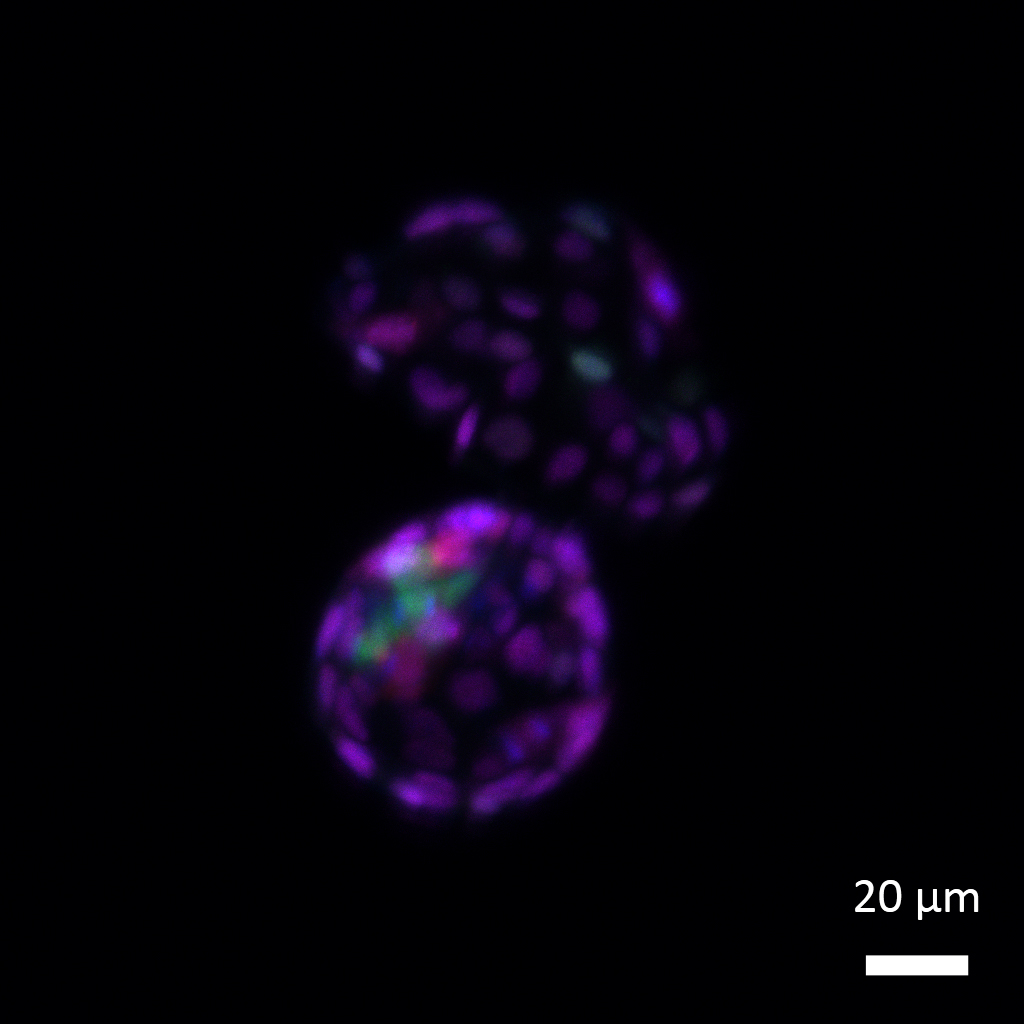
אבל האם ניתן לבטל את הסימון ולשחרר את הנעילה? כדי לבדוק זאת, הנדסו המדענים תאי גזע עובריים כך שיהיו ללא היסטון H1 או ללא האנזים האחראי על הצמדת ה-SUMO לחלבונים. הם ראו כי תאים אלה חזרו אחורה בזמן: הכרומטין שלהם נפתח, הם חזרו לבטא יותר מ-100 גנים המעורבים בטוטיפוטנציה ויכלו לייצר תאים שבאפשרותם להתמיין לרקמות חוץ-עובריות, בהן השליה.
ליכולת להחזיר תאים בוגרים למצב מוקדם יותר יש משמעויות שחורגות בהרבה מהמעבדה. כך למשל מנגנון דחיסת הכרומטין עשוי להיות מעורב במצבי מחלה שונים, בהם סרטן, שכן שיבושים במנגנון זה עשויים לאפשר לתאים ממאירים לחזור למצב התפתחותי מוקדם יותר, המאופיין בצמיחה מהירה. בנוסף, שליטה מוגברת בתהליך ההבשלה של התא עשויה לקדם מאוד את התחום המבטיח של הנדסת רקמות וגידול איברים להשתלה. "פתיחת הנעילה של הכרומטין וארגון מחדש של הסידור המרחבי שלו עשויים להתגלות ככלי עוצמתי לצורך התחדשות ויצירת רקמות למטרות ריפוי", מבהיר ד"ר שיבאן.
במחקר השתתפו גם: ד"ר תום שני, אלחנדרו אגילרה, ד"ר נופר מור, ד"ר ברנרדו אולדק, ד"ר ג'ונתן ביירל, סרגיי ויוקוב, ד"ר ולדיסלב קרופלניק, ולריה צ'וגאבה, שאדי טרזי, אלחנדרה רודריגז דה לה רוזה, מרי זרביב וד"ר נועה נוברשטרן ממעבדתו של פרופ' חנא; רועי מור, ד"ר מירב שמואלי, ד"ר אביטל אייזנברג לרנר, גויון שן, ד"ר אסף קסן, ד"ר עדי אולמן וסולימאן מסראוי ממעבדתה של ד"ר מרבל; ג'קוב הרברט וד"ר יעל דוד ממרכז הסרטן ממוריאל סלואן קטרינג; ד"ר מיטל קופרווסר וד"ר ישי לוין מהמרכז הישראלי הלאומי לרפואה מותאמת אישית על-שם ננסי וסטיבן גרנד; וד"ר אפרת שמע מהמחלקה לאימונולוגיה ורגנרציה ביולוגית של המכון.
ישנם כ-200 תגים מולקולריים שביכולתם לשנות את התפקוד של חלבונים לאחר שכבר נוצרו.