עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
הירשמו לניוזלטר החודשי שלנו:
פתחתם את הפייסבוק וראיתם שיש לכם בקשת חברות חדשה. השם של מבקש החברות מוכר לכם, אבל יש לו מעט חברים ושפע פרסומות מוזרות בעמוד. האם תאשרו את הבקשה? בדומה לשיקול הדעת שעוזר לנו לזהות מתחזים ברשתות החברתיות, המערכת החיסונית שלנו יודעת לזהות תאים מסוכנים על סמך "פרופילים" תאיים שהם מציגים. תאי המערכת החיסונית משייטים בגוף ובוחנים חלבונים המכונים "אנטיגנים" המוצגים על-גבי התאים. כאשר פרופיל האנטיגנים של תא מסוים מעורר חשד, המערכת פועלת להשמדתו.
האנטיגנים המרכיבים את הפרופיל התאי מיוצרים, בין היתר, בידי מערכת הקרויה פרוטאזום – מעין פח אשפה תאי המתמחה בפירוק חלבונים שסיימו את תפקידם או שניזוקו לאורך הזמן. חלבונים אלה מוכנסים לפרוטאזום ושם מפורקים לפפטידים – שרשראות חלבון קצרות יותר – שחלקם מיועדים למיחזור, וחלקם נשלחים לעיבוד נוסף שבסופו יוצגו על-גבי התא כאנטיגנים. תאים סרטניים מציגים פעמים רבות אנטיגנים מעוררי חשד, שכן מערכות בקרה שונות של התא משתבשות בסרטן ומגדילות את הסיכוי לייצור חריג של חלבונים. כאשר המערכת החיסונית נחשפת לפרופיל הסרטני החשוד, היא יכולה לתקוף, אך בפועל, מסיבות שונות, זה לא תמיד קורה. במחקר חדש שהתפרסם באחרונה, חוקרים ממעבדתה של פרופ' יפעת מרבל במחלקה לאימונולוגיה מערכתית במכון ויצמן למדע, טמנו ידיהם במעמקי האשפה התאית ושלפו משם מנגנון שבאמצעותו משבשים תאי הסרטן את היכולת של המערכת החיסונית לזהות אותם.

אין זו הפעם הראשונה שמעבדתה של פרופ' מרבל שמה את מערכת פינוי האשפה התאית תחת העדשה. בשנים האחרונות חברי המעבדה פיתחו טכנולוגיות מתקדמות המאפשרות להם למפות את החלבונים שעוברים פירוק בפרוטאזום. המידע מתקבל ברזולוציה גבוהה, כך שניתן לזהות באמצעותו את המבנה הייחודי של פפטיד שנחתך בפרוטאזום.
דמיינו שהפרוטאזומים השונים הם שני שפים שמעדיפים תיבול שונה. הפרוטאזום הבסיסי אוהב לבשל פפטידים חמצמצים, ואילו האימונו-פרוטאזום מכין פפטידים מתוקים שמושכים את תאי המערכת החיסונית
במחקר החדש, בהובלתם של אהרון ג'אביט ומרב שמואלי, נעשה שימוש בטכנולוגיות אלה על מנת לבחון בפעם הראשונה את פחי האשפה התאיים בסרטן. "לקחנו את המערכת הזו וניסינו להבין מה קורה לפינוי האשפה ולחלבונים המפורקים בה ברקמות סרטניות של חולים בסרטן הריאה הנפוץ ביותר. כשערכנו השוואה בין תוצרי החיתוך של הפרוטאזום ברקמת הסרטן לאלה מרקמה סמוכה שאינה סרטנית, ראינו שאותם החלבונים עוברים חיתוך מסוג שונה", מספרת פרופ' מרבל. הממצאים העלו את הרעיון שאולי צריך להסתכל על הפרוטאזום מזווית חדשה – לבדוק איך פועל בית החרושת לפירוק חלבונים, ולא רק אילו תוצרים עברו דרכו. "הסתכלנו על הרקמה הסרטנית ושאלנו – איך הפרוטאזום משתנה?"
פרוטאזום הוא קומפלקס של חלבונים המורכב מתתי-יחידות: מרכז הפרוטאזום הוא מעין חבית חלולה המכילה אנזימים שונים שמתמחים בחיתוך האשפה התאית, שאליו יכולים להיקשר חלבונים נוספים המשמשים מעין מכסים המווסתים את כניסת החלבונים. פרוטאזומים נבדלים אלה מאלה בעיקר על-פי האנזימים המרכיבים את מרכזם. למשל, הרכב האנזימים של פרוטאזום המכונה "הפרוטאזום הבסיסי" (constitutive proteasome) אחראי לחיתוכים מסוג מסוים, בעוד פרוטאזום בעל מרכיבים אחרים, המכונה אימונו-פרוטאזום (immunoproteasome), מתמחה בחיתוך פפטידים שמתאימים במיוחד לשמש כאנטיגנים – אותם פרופילים תאיים שיכולים לסייע למערכת החיסונית לזהות גורמים בלתי-רצויים.
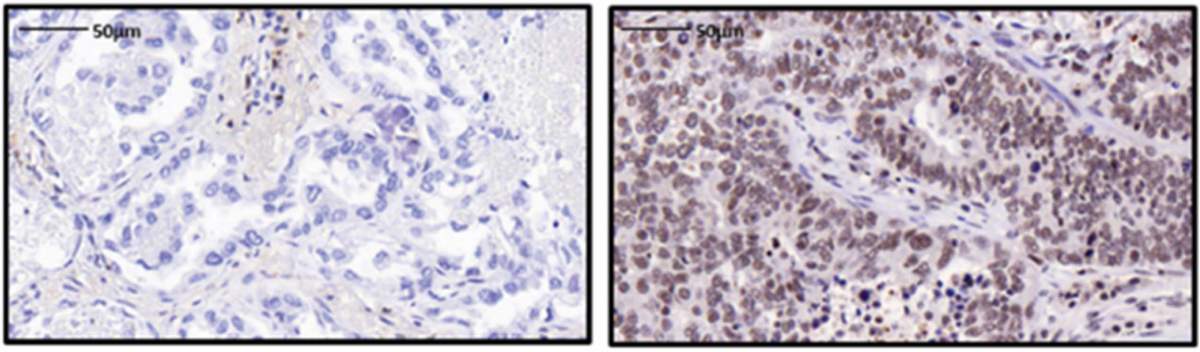
כשהחוקרים יצאו לחטט בפחי האשפה בגידולי סרטן ריאות שהוצאו מחולים, הם הבחינו בעלייה משמעותית במספר הפרוטאזומים עם החלבון PSME4, בהשוואה לרמת הביטוי של אותו החלבון בפרוטאזומים של רקמות בקרה סמוכות לא-סרטניות. החלבון PSME4 הוא אחד ממיני מכסים שונים שיכולים להרכיב את הפרוטאזום, אך ניכר שהשימוש בו אינו נפוץ במיוחד ברקמה שאינה סרטנית.
לאחר שהחוקרים וידאו שחלבון ה-PSME4 אכן נקשר לפרוטאזומים בדגימות הסרטניות, הם החלו לאפיין את אופי החיתוך של הפרוטאזומים שבהם הוא מתבטא. לצורך המחשה, דמיינו שהפרוטאזומים השונים הם שני שפים שמעדיפים תיבול שונה. הפרוטאזום הבסיסי אוהב לבשל פפטידים חמצמצים, ואילו האימונו-פרוטאזום מכין פפטידים מתוקים שמושכים אליהם את תאי המערכת החיסונית. באמצעות שיטות ביוכימיות מורכבות, הראו החוקרים שככל שעולה ריכוז חלבון ה-PSME4, כך התא מייצר יותר מהמנות החמצמצות, בעוד כמות הפפטידים המתוקים הולכת ופוחתת. בסדרת ניסויי המשך הראו החוקרים כי חוסר האיזון בין סוגי האנטיגנים החמצמצים למתוקים מקשה על המערכת החיסונית לאפיין את הפרופיל התאי, ובכך נמנעת תגובה חיסונית רצויה שאמורה להילחם בתאי הסרטן.
ממצאים אלה הובילו להשערה שייתכן שרמת הביטוי של החלבון PSME4 משפיעה על התגובה של חולי סרטן לאימונותרפיה – הדור החדש של טיפולי הסרטן אשר מגייס ומפעיל את המערכת החיסונית נגד הגידולים הממאירים. לפיכך פנו החוקרים למאגרי מידע שיתופיים הכוללים נתונים על גידולים סרטניים שונים ועל תגובותיהם של מטופלים לשיטות טיפול שונות. הם גילו שהרכב הפרוטאזום משתנה ללא היכר בין סוג סרטן אחד למשנהו, ולכל סרטן מערכת פינוי אשפה שונה. בנוסף, הם ראו שהעלייה בביטוי החלבון PSME4 אמנם לא אפיינה את כל סוגי הסרטן, אבל באופן גורף ניכר שככל שרמת החלבון הייתה גבוהה יותר בסרטן, כך ירדה תגובת החולים לטיפולים אימונותרפיים.
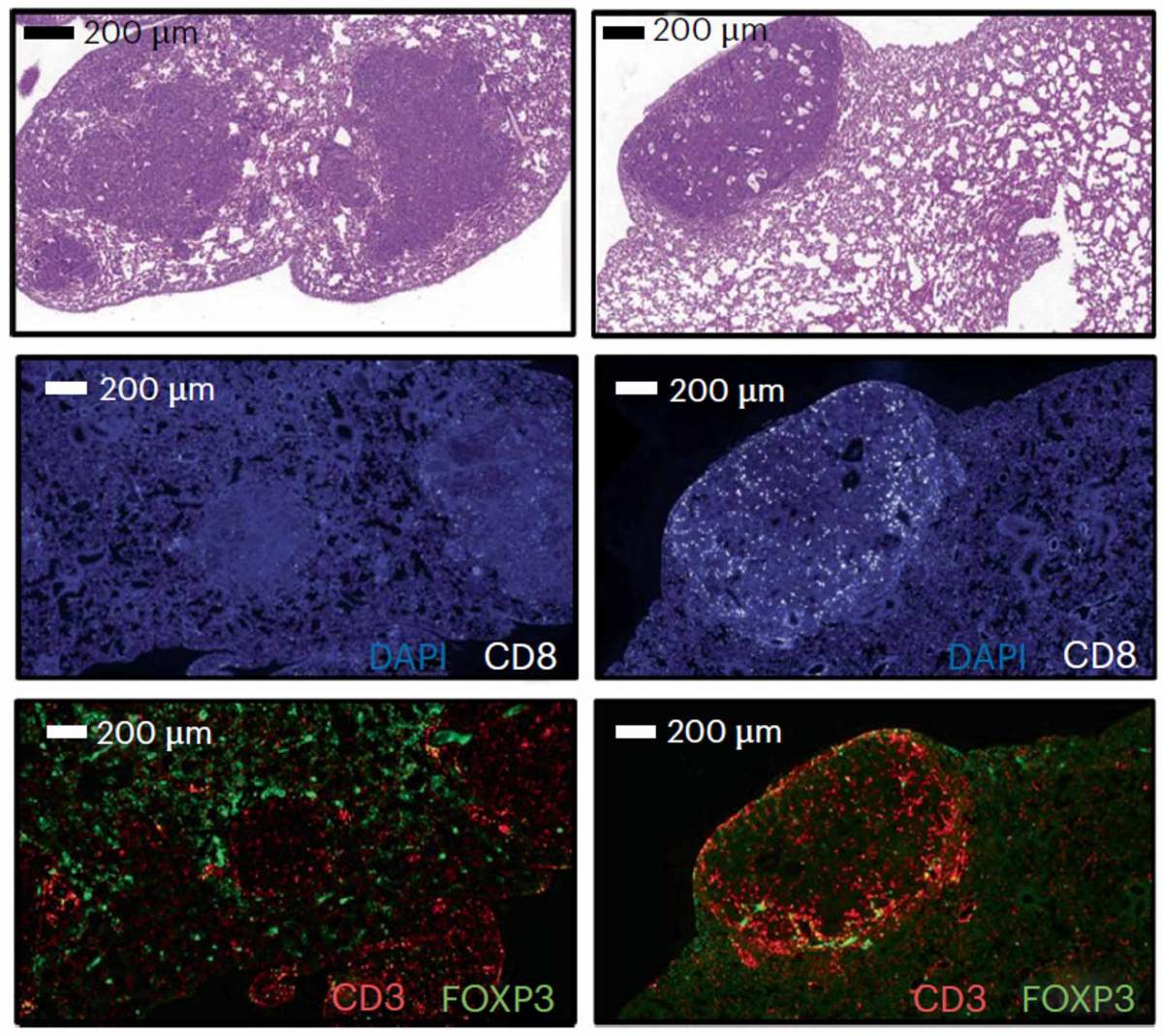
כדי לוודא שהחלבון PSME4 משפיע על פעילות המערכת החיסונית באופן ישיר, ערכו החוקרים סדרה של ניסויים במודל של סרטן הריאות בעכברים. בבדיקות הללו הסתמן שרמת הביטוי של החלבון PSME4 הינה כל-כך משמעותית להישרדות הסרטן, שעכברים שהונדסו לבטא יותר מהחלבון בתאי הסרטן פיתחו רקמות גדושות בגידולים סרטניים. לעומת זאת, החוקרים בקושי זיהו גידולים סרטניים בעכברים שהונדסו לבטא מעט PSME4 בתאי הסרטן. לבסוף, כשבחנו עכברים שאין להם מערכת חיסונית, ראו שהגידולים לא הושפעו כלל מרמת הביטוי של החלבון, ממצא שחיזק את ההשערה ש-PSME4 משפיע על הסרטן באמצעות המערכת החיסונית.
"המחקר שלנו התמקד בסרטן ריאות מסוג תאים לא קטנים (NSCLC), אבל הנתונים שפרסמנו מצביעים על כך שישנם עוד סוגי סרטן שבהם החלבון PSME4 מתבטא ברמה גבוהה", מסכמת פרופ' מרבל, ומדגישה את הצורך להציץ אל תוככי מערכת פינוי האשפה של הסרטן, שם מסתתרים מנגנונים נוספים המשפעים על פעילותה של המערכת החיסונית. כעת שואפים החוקרים לפתח תרופה שתוכל להפחית את רמות הביטוי של החלבון PSME4 ברקמה הסרטנית, ובכך אולי לשפר משמעותית את היכולת של המערכת החיסונית לתקוף את הסרטן. אמנם הדרך לפיתוח תרופה עוד ארוכה, אך הממצאים מדגימים כיצד אפיון הפרוטאזום בגידול הסרטני יכול לעזור לרופאים לקבל החלטה מותאמת אישית בנוגע לטיפול הנכון עבור המטופל.

רק 20% עד 40% מחולי הסרטן מגיבים כיום לאימונותרפיה, עם שונות גבוהה בין סוגי הסרטן השונים.