במונחים מיקרוסקופיים, קרום התא מכיל ממברנה כמעט בלתי-חדירה,המורכבת מליפידים (חומרים דמויי שומן), והחלבון מוטמע בה וחוצה אותה לכל עוביה.
המחקר הראשון, שהתפרסם בכתב-העת המדעי
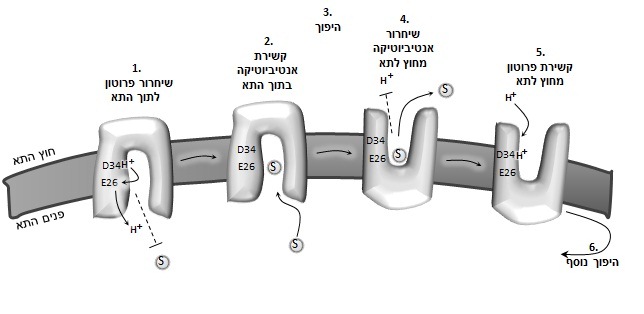
Molecular Cell, זיהה בחלבון את האתר החומצי האחראי לקישור ולשיחרור הפרוטון. אתר זה נמצא בתווך הממברנה, ומשמש כמעין תחנת עצירה של הפרוטון בין שני צידיה. ממצאי המחקר מראים, שהאתר החומצי יכול לחוש גם את קישור האנטיביוטיקה לחלבון. בעת קישור אנטיביוטיקה משחרר האתר את הפרוטון הקשור אליו לתוך התא. מנגנון זה מאפשר לתאם את הוצאת האנטיביוטיקה עם הכנסת הפרוטון. המנגנון פועל גם בכיוון השני, כלומר, גם קישור של פרוטון יגרום לשיחרור האנטיביוטיקה הקשורה לחלבון. תופעה זו ידועה בשם "תחרות" על קישור. ואכן, המדענים מצאו שתחרות על הקישור היא חיונית לפעילות החלבון MdfA. למרבה ההפתעה, מתברר שהאנטיביוטיקה והפרוטון נקשרים למקומות שונים, ומכאן שהמידע לגבי קישור של פרוטון או אנטיביוטיקה מעובד על-ידי החלבון ומועבר לאתר הקישור השני. השינויים המבניים המתרחשים בחלבון תוך כדי עיבוד המידע על קישור הפרוטון עומדים בבסיס תהליך סילוק האנטיביוטיקה מהתא.
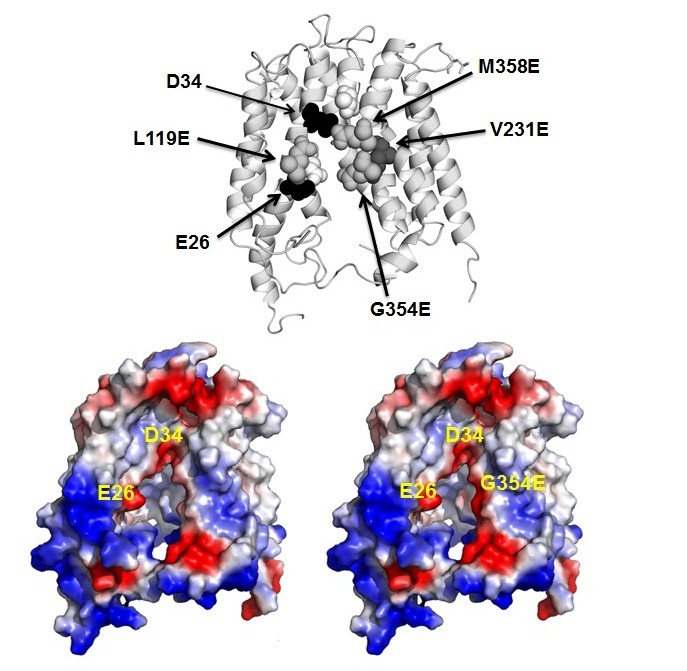
במחקר השני ניסו פרופ' ביבי ותלמידיו לאתגר את החלבון, כך שיוכל להעביר שני פרוטונים. החלבון MdfA יכול להכניס רק פרוטון אחד עבור כל מולקולת אנטיביוטיקה מסולקת, ולכן אין באפשרותו לספק לתא החיידק הגנה מפני חומרים רעילים מסוימים, שסילוקם מהתא מחייב הכנסה של שני פרוטונים. החוקרים סרקו שינויים גנטיים אקראיים בחלבון, ומצאו מוטציה שמעניקה עמידות גם לחומרים המחייבים מעבר שני פרוטונים. ואכן, שינויים גנטיים אלו יצרו אתר חומצי נוסף, הממוקם קרוב לאתר קישור הפרוטון שבחלבון הטבעי.
בעזרת האתר החומצי החדש מסוגל החלבון המוטנטי להעביר פרוטון נוסף. תוצאות אלו עוררו השערה, שמנגנון העברת הפרוטון הוא מודולרי, כך שיצירת אתרים חומציים באיזור זה של החלבון עשויה לאפשר העברת שני פרוטונים. תפיסה זו אוששה בטכניקה של הנדסה גנטית, בניסויים שבהם תוכננו אתרים חומציים נוספים אשר איפשרו עמידות לאנטיביוטיקות המחייבות מעבר של שני פרוטונים.
ממצאים אלו התפרסמו בכתב-העת המדעי רשומות האקדמיה האמריקאית למדעים (
PNAS), והם ממחישים את הפוטנציאל הרב של החיידק לרכוש עמידות לאנטיביוטיקות חדשות.