עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
הירשמו לניוזלטר החודשי שלנו:
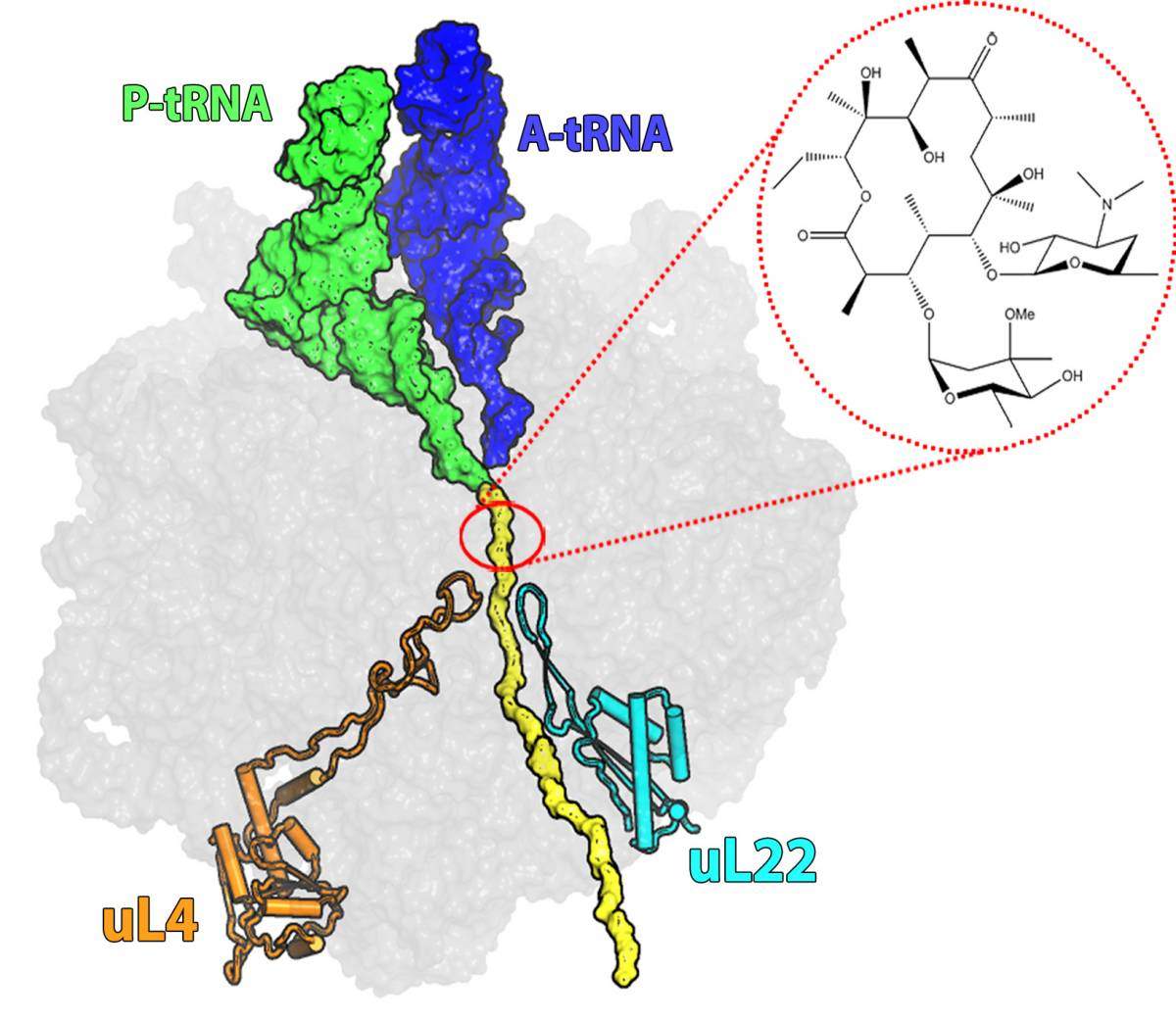
בתחילת יולי פירסם ארגון הבריאות העולמי אזהרה: בעקבות עמידות גוברת שפיתח החיידק מחולל מחלת הזיבה לאנטיביוטיקה, לא ירחק היום, ולמחלה זו לא יהיה מרפא. האזהרה זכתה לכותרות בעיתונים ברחבי העולם, אבל למעשה, אין מדובר במקרה חריג: פריחתם של "חיידקי-על", שפיתחו עמידות בפני סוגי האנטיביוטיקה הקיימים, היא סכנה אשר אורבת לפתחה של האנושות, ומאיימת להסיג את הרפואה יותר מ-70 שנים לאחור, לעידן טרום-האנטיביוטיקה. כדי להרחיק את הסכנה, יש לפתח סוגים חדשים של אנטיביוטיקה ולהגביר את היעילות של הסוגים הקיימים. לשם כך יש להבין לעומקם את המנגנונים המולקולריים המדויקים של פעילות תרופות אלה, וכן את מנגנוני העמידות שמפתחים החיידקים. מחקר חדש של מדעני מכון ויצמן למדע, שהתפרסם באחרונה בכתב-העת המדעי Structure, פיצח את אחד ממנגנוני העמידות לאחת מהאנטיביוטיקות הוותיקות ביותר – אריתרומיצין.
אנטיביוטיקה איננה המצאה אנושית, כי אם מנגנון הגנה טבעי של חיידקים שהתגלה בשנות ה-20 של המאה הקודמת, ונכנס לשימוש קליני לאחר מלחמת העולם השנייה. חיידקים מייצרים אנטיביוטיקה במטרה לחסל חיידקים אחרים כחלק מ"מאבקי שליטה" בין אוכלוסיות חיידקים. כשם שחיידקים מייצרים אנטיביוטיקה, הם מפתחים גם מנגנוני הגנה מפניה. לפיכך, עמידות חיידקים בפני אנטיביוטיקה קיימת בטבע ללא קשר למעשיו של האדם. עם זאת, השימוש הנרחב של בני אדם באנטיביוטיקה האיץ את קצב פיתוח העמידות, והגביר מאוד את שכיחותם של "חיידקי-על". גם את האנטיביוטיקה אריתרומיצין, שהתגלתה בשנת 1949 ונמצאת עד היום בשימוש קליני, מייצר בעצם חיידק. אריתרומיצין שייכת למשפחת המאקרולידים, משפחה של אנטיביוטיקות הפועלות באמצעות היקשרות לריבוזום, "בית החרושת" של התא לייצור חלבונים. התרופה משביתה את הריבוזומים בתאי החיידקים, ובכך מונעת מהם לייצר חלבונים, ובסופו של דבר גורמת להכחדתם.
אנשים כיום מתים ממחלות זיהומיות כמו דלקת ריאות, ולא רק במדינות עולם שלישי. ממצאים אלה עשויים לסייע לפיתוח תרופות עתידיות שיוכלו להתגבר על מנגנוני העמידות של החיידקים"

כ-40% מהתכשירים האנטיביוטיים הנמצאים בשימוש פועלים באמצעות היקשרות לריבוזום, אך לכל אחד מהם מנגנון שונה. כך למשל, מולקולת אריתרומיצין נקשרת לאיזור המכוּנֶה "מנהרת היציאה", שדרכה יוצאים החלבונים אשר נוצרו בריבוזום. בעקבות היקשרות זו של התרופה נחסמת המנהרה, וייצור החלבונים בחיידק מעוכב. במרבית החיידקים שפיתחו עמידות לאריתרומיצין התחוללה מוטציה, אשר אינה מאפשרת למולקולה להתחבר לכיס הקישור בכניסה למנהרה, וכך למלא את תפקידה. עם זאת, בחלק מהמקרים, גם כאשר מולקולת האריתרומיצין נקשרה לריבוזום, הצליחו החיידקים לפתח כלפיה עמידוּת, שעד כה לא נמצא לה הסבר. עמידות זו היא תולדה של מוטציה בחלבון ריבוזומלי המכונה L22. ד"ר איתי וקסלמן, שהוביל את המחקר כחלק מעבודת הדוקטורט שלו במעבדה של כלת פרס נובל לכימיה, פרופ' עדה יונת, במחלקה לביולוגיה מבנית במכון ויצמן למדע, מסביר את התעלומה סביב מנגנון עמידות זה: "למולקולה האנטיביוטית אין כל מגע – אין כל קשר כימי – עם החלבון שבו התרחשה מוטציה. למעשה, חלבון זה נמצא רחוק יחסית, במושגים כימיים ומבניים. אף על פי כן, למרות שהחלבון המוטנטי אינו מפריע לכאורה לפעולת האריתרומיצין, התפתחה כאן עמידות בפני האנטיביוטיקה".
כדי לפתור חידה זו הסתמכו ד"ר וקסלמן, ד"ר ענת בשן, ד"ר אלה זימרמן, ד"ר חיים רוזנברג וחברים נוספים בקבוצתה של פרופ' יונת, בשיתוף עם ד"ר ג'ניס זנגל מאוניברסיטת מרילנד בארה"ב ופרופ' האנה אינגמר מאוניברסיטת קופנהגן בדנמרק, על העבודה רבת-השנים ופורצת הדרך של פרופ' יונת אשר פיענחה את מבנה הריבוזום, ואף פיתחה אפשרויות שימוש מתקדמות בתחום הקריסטלוגרפיה באמצעות קרני רנטגן, שבזכותן ניתן לפענח את המבנה התלת-ממדי של הריבוזום ברמת דיוק הקרובה לרזולוציה אטומית. כך הצליחו החוקרים לקבל מפות צפיפות אלקטרונים של מבנה הריבוזום עם המוטציה ובלעדיה, וכן בנוכחות מולקולת האריתרומיצין ובהיעדרה. בעקבות מיפוי זה התגלה, כי המוטציה בחלבון משנה את המבנה התלת-ממדי של לולאה הנמצאת בקצה החלבון L22. בעקבות שינוי זה מתרחבת הלולאה ונעה לכיוון מרכז המנהרה, ואז מתחולל "אפקט דומינו", אשר משנה את מיקומם של מספר בסיסי RNA שמהם מורכבת דופן המנהרה. כתוצאה משינויים מרחביים אלה, אשר מגיעים עד לאתר הקישור של האנטיביוטיקה, מולקולת האריתרומיצין אמנם מצליחה להיקשר לכיס הקישור, אך המנהרה אינה נחסמת – והחיידק יכול להמשיך לגדול.
אם חברות התרופות לא יחשבו ויפעלו מהר, בתוך עשרים עד שלושים שנה נחזור לתקופה שלפני השימוש באנטיביוטיקה"

באחרונה פורסם בכתב-העת המדעי mBio מחקר נוסף של המעבדה של פרופ' יונת, בשיתוף חוקרים מאוניברסיטת מונש באוסטרליה ומהאוניברסיטה הטכנולוגית נניאנג בסינגפור. במחקר זה חשפו המדענים, בעזרת שיטות חדישות במיקרוסקופיית אלקטרונים, את המנגנון המולקולרי המאפשר לחיידק סטפילוקוק זהוב לחמוק מטיפול אנטיביוטי. ד"ר בשן מסבירה את החשיבות של מחקרים אלה: "אנשים כיום מתים ממחלות זיהומיות כמו דלקת ריאות, ולא רק במדינות עולם שלישי. ממצאים אלה עשויים לסייע לפיתוח תרופות עתידיות שיוכלו להתגבר על מנגנוני העמידות של החיידקים". עם זאת, מספר התרופות האנטיביוטיות החדשות הנכנסות לשימוש קליני אינו גדול, שכן חברות התרופות אינן משקיעות די משאבים בפיתוח סוגי אנטיביוטיקה חדשים, בשל הרווחיות המועטה הצפויה מתכשירים אלה. פרופ' יונת התריעה על כך בעבר: "אם חברות התרופות לא יחשבו ויפעלו מהר, בתוך 20-30 שנה נחזור לתקופה שלפני השימוש באנטיביוטיקה".
ארגון הבריאות העולמי הזהיר באחרונה כי מספר מקרי המוות כתוצאה מחיידקים עמידים עשוי לעלות ל-10 מיליון מקרים בשנה עד שנת 2050 – יותר ממספר מקרי המוות כתוצאה מסרטן וסוכרת גם יחד. #מספרי_מדע |