משנה מקום, משנה מזל. אבל האם שינוי במיקום משנה גם את מהות הפעולה? שאלה זו עלתה כשהתגלתה קבוצה של אנזימים ממשפחה ידועה, שהתמקמו במקום שעד כה לא היה ידוע שהם עשויים להימצא בו. מדובר במשפחת אנזימי הפרוטאז, האחראיים על תהליכים של חיתוך חלבונים בתאי הגוף. אנזימים אלה נפוצים בבעלי-חיים רבים מאוד, והם מעורבים במספר רב עוד יותר של תהליכי חיים בסיסיים. בשל תפוצתם הרחבה ותפקידם המרכזי הם נחקרו לרוחב ולעומק. המבנה ומנגנוני הפעילות שלהם ידועים לפרטים. אבל באחרונה הצטברו עדויות לקיומם של בנים חורגים במשפחת אנזימי הפרוטאז - שאינם פועלים בחלל התא, כמו בני המשפחה האחרים, אלא ממוקמים בתוך קרום התא.
לכאורה, מדובר בסך הכל בשינוי במיקום האנזים, אך למעשה, מעלה המיקום הזה שאלה עקרונית. חיתוך חלבונים הוא תהליך המחייב נוכחות של מולקולות מים, ולכן הוא נעשה בסביבה הידרופילית (אוהבת מים), דוגמת חלל התא. לעומת זאת, קרום התא הוא סביבה שומנית הדוחה מים. כיצד, אם כן, מצליחים האנזימים הממוקמים בקרום התא למלא את יעודם ולחתוך חלבונים? המדענים שיצאו למצוא תשובה לשאלה זו גילו, שאנזימי הפרוטאז הממוקמים בקרום התא מבצעים מיגוון תפקידים נוספים: העברת אותות של תקשורת ביוכימית בתוך התא, בקרת מוות מתוכנת של תאים, התגוננות מפלישת טפילים, ועוד. אבל לא כל הפעילויות האלה חיוביות. לדוגמה, חיתוך מסוים שמבצעים האנזימים הללו מוביל להיווצרות מקטעים של החלבון עמילואיד בתא, שהצטברותו במוח מאפיינת את מחלת האלצהיימר.
פרופ' איתן ביבי והחוקר הבתר-דוקטוריאלי ד"ר אדם בן-שם מהמחלקה לכימיה ביולוגית, ופרופ' דבורה פאס מהמחלקה לביולוגיה מבנית, שבפקולטה לכימיה במכון ויצמן למדע, ביקשו לפענח את סוד פעילותם של אנזימי הפרוטאז בסביבה השומנית דוחת המים של קרום התא. כדי לעשות זאת, הם הפעילו שיטת מחקר מתקדמת, שאיפשרה להם ליצור תמונה מפורטת, תלת-ממדית וברזולוציה גבוהה, של אנזים פרוטאז מחיידק E.coli. ממצאי המחקר, שפורסמו באחרונה בכתב העת "רשומות האקדמיה הלאומית למדעים של ארה"ב" (PNAS), מצביעים על פתרון אפשרי לתעלומת מנגנון הפעילות של האנזים.
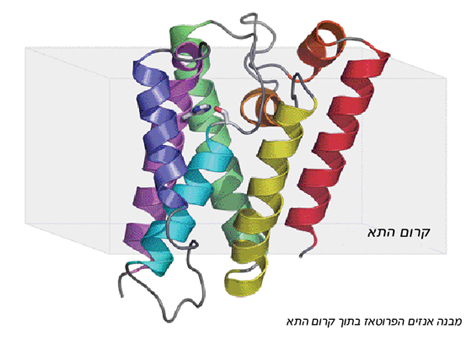
הממצאים מראים, כי האנזים מורכב משישה סלילים החוצים את קרום התא, ומחוברים זה לזה באמצעות לולאות. חמישה מהסלילים יוצרים מעין גליל, כשהם מקיפים את הסליל השישי, אשר עליו נמצא האתר הפעיל של האנזים. בניגוד לחמשת הסלילים ההיקפיים, החוצים את הקרום לרוחבו ובולטים משני צדדיו, הסליל המרכזי קצר יותר, כך שהאתר הפעיל שקוע בתוך קרום התא. מעל לאתר הפעיל נוצר מבנה דמוי כיס: חלקו העליון פתוח אל הסביבה החיצונית, ותחום מכל צדדיו בסלילי החלבון. חלקו הפנימי של הכיס "מרופד" בחומצות אמינו "אוהבות מים", והאתר הפעיל של האנזים בולט מתחתיתו. המבנה המיוחד הזה מאפשר חדירת מולקולות מים אל מעמקי קרום התא, היישר אל המקום שבו הן נחוצות.
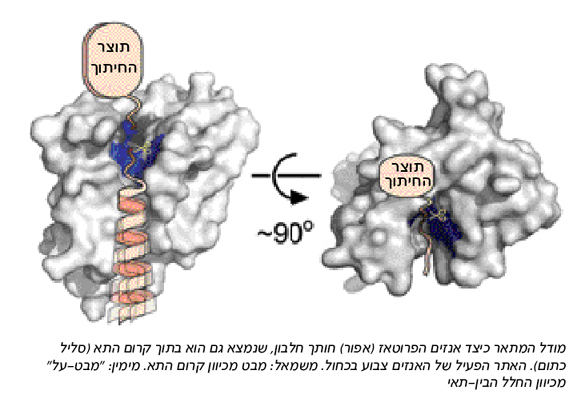
גילויים אלו אמנם עונים על השאלות הנוגעות למיקום האתר הפעיל של האנזים, ולאופן שבו הוא מבצע חיתוך המחייב נוכחות של מים, אבל הם מעלים שאלה אחרת, הנוגעת לחלבון שאותו חותך האנזים, שאף הוא ממוקם בקרום התא. כיצד מתאפשרת הגישה של חלבון זה אל האתר הפעיל, הנמצא במעמקי האנזים, מוקף בסלילי חלבון צפופים? ממצאי המחקר מציגים מספר אפשרויות: אחת הטבעות המקשרת שניים מסלילי החלבון עשויה לתפקד כמעין "שער", שפתיחתו מאפשרת לחלבון לגשת אל האתר הפעיל של האנזים. במקום אחר זוהה פתח דמוי האות V בין שני סלילים. בכל מקרה, מאחר שהאתר הפעיל מרוחק מהפתחים, משערים החוקרים כי יש צורך גם בשינוי מבני של האנזים או של החלבון המיועד לקטיעה. "שינוי במבנה הסלילי של החלבון המיועד לקטיעה עשוי לאפשר לו גישה לאתר הפעיל של האנזים, וגם לחשוף את נקודת החיתוך", אומר פרופ' ביבי. "הסביבה 'אוהבת המים' באתר הפעיל של האנזים מאפשרת שינוי מבני כזה - ומייצבת אותו".
מיקומו של האנזים, בקרום התא, מקשה על החוקרים לחשוף את צפונותיו הנוספות. כדי לעשות זאת ייאלצו המדענים למצוא דרך לחקור אותו בסביבתו הטבעית, בתוך קרום התא, כשהוא בא במגע עם החלבונים שהוא חותך. אתגר זה עומד במרכז מחקריו העכשוויים של פרופ' ביבי.