צוות מדענים ממכון ויצמן למדע ומהאוניברסיטה העברית בירושלים הצליח לפענח את המבנה המרחבי התלת-ממדי של אברון תוך-תאי,המשמש מעין "עורך מולקולרי" של המידע הגנטי שלפיו מיוצרים בתא החלבונים, שהם עיקר מניינו ובניינו של הגוף. שיבושים וטעויות בפעולתו של "העורך המולקולרי", הקרוי ספלייסוזום, אחראים להפרעות בריאותיות ולהתפתחות מחלות שונות. לפיכך, פיענוח המבנה של הספלייסוזום והבנת מנגנון פעולתו ו"שיקולי העריכה" שלו, פותחים אפשרויות לפיתוח דרכים חדשות להילחם במחלות אלה.
במשך שנים רבות סברו הביולוגים, שהמידע הכלול בטקסט הגנטי נשמר בקפדנות, ושגן אחד מקודד את המידע הדרוש לבנייתו של חלבון אחד. אבל במשך הזמן התברר, שבדרכו מהגנים אל הריבוזומים (הקוראים את הטקסט ומייצרים לפיו חלבון), עובר הטקסט הגנטי שינויים רבים ושונים, מעין תהליך של "הבשלה", המזכיר במידה רבה את עבודתו של עורך לילה במערכת של עיתון יומי - קיטועים, חיבורים, מחיקות.
המידע הגנטי הנשלח מהגנים שבגרעין התא, אל הריבוזומים שמצויים בחלל התא, אצור במולקולות חד-גדיליות של קדם RNA שליח, המתפתחות בהמשך ל- RNA שליח. גדיל בודד זה יוצא לדרכו אל מחוץ לגרעין התא, אל הציטופלסמה שבה מצויים הריבוזומים הקוראים את הצופן הגנטי ויוצרים על-פיו חלבונים. החיים היו יכולים להיות פשוטים למדי אם אכן כך היו מתנהלים הדברים. אלא שפיליפ שארפ וריצ'רד רוברטס גילו, שהתיאור הזה אינו אלא "מסגרת" שבתוכה מתחוללים תהליכי ביניים רבים, המתבצעים בדרך דומה לדרך שבה טקסטים שונים נערכים, מוגהים ומובאים לדפוס. הם מצאו שמולקולת הקדם RNA שליח, המהווה העתק של רצף ה- DNA של הגנים, נקטעת במקומות שונים, כך שקטעים מסוימים שלה מוצאים ממקומם ו"מבוטלים", בעוד הקטעים האחרים (הנשארים) "מצמצמים רווחים", נצמדים זה לזה ויוצרים "סדר גנטי חדש". בהמשך התברר, שהקטעים ש"מבוטלים" או "נותרים על רצפת חדר העריכה" בתהליך הזה (הקרויים אינטרונים) אינם נושאים מידע הדרוש לבניית החלבון; ואילו הקטעים שנותרים ומתחברים זה לזה (הקרויים אקסונים) יוצרים בהתחברם את הרצף הגנטי ה"אמיתי", הצופן את המידע הדרוש לבנייתו של החלבון. כך, למעשה, גן אחד, שהמידע האצור בו עובר תהליכי עריכה שונים, יכול להוביל ליצירת כמה חלבונים שונים. תגלית זו זיכתה את שארפ ורוברטס בפרס נובל לרפואה ולפיסיולוגיה לשנת 1993.
מאז התגלית הזו מנסים מדענים רבים, בכל העולם, להבין את המנגנון האחראי לתהליך העריכה הגנטית. פעולת החיבור של המקטעים נושאי המידע שב-RNA שליח (הקרויה splicing RNA), מתבצעת באברון תוך-תאי המצוי בגרעין התא וקרוי "ספלייסוזום". אברון זה עשוי כמעין פקעת מסובכת של חלבונים וגדילים קצרים של RNA, והוא גוזר ותופר את מולקולת הקדם RNA שליח על פי רצפים קבועים של "אותיות גנטיות" המצויים בהתחלה ובסוף של כל מקטע נושא מידע.
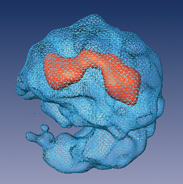
אבל כיצד פועל הספלייסוזום? המחקר הנוכחי של פרופ' יוסי שפרלינג מהמחלקה לכימיה אורגנית במכון ויצמן למדע, ורעייתו, פרופ' רות שפרלינג מהמחלקה לגנטיקה באוניברסיטה העברית בירושלים, מהווה צעד חשוב לפתרון תעלומה זו. יחד אתם עבדו תלמידת המחקר מאיה אזובל, ושרון וולף מהמחלקה לתשתיות מחקר כימי במכון ויצמן. במאמר שפורסם באחרונה בכתב העת המדעי Molecular Cell מתארים חברי הצוות כיצד הצליחו ליצור מפה ראשונית של המבנה המרחבי התלת-ממדי של "העורך הגנטי", הספלייסוזום, דברשמאפשר להבין גם את מנגנון פעילותו. כדי לעשות זאת חילצו המדענים ספלייסוזומים מתאים חיים, ובחנו אותם באמצעות מיקרוסקופ אלקטרונים.
חילוץ הספלייסוזומים מהתאים החיים ופיענוח המבנה שלהם הם מלאכות לא פשוטות. הספלייסוזום מורכב מארבעה מבנים זהים המשתלבים זה בזה, וכל אחד מהם מהווה, למעשה, מעין ספלייסוזום עצמאי המסוגל לחבר מקטעים גנטיים בכוחות עצמו. השילוב בין המבנים השונים הוא דינמי, כך שייתכנו שילובים שונים, העשויים להתחלף זה בזה. דינמיות זו מקשה מאוד, כמובן, על ניסיון לפענח את המבנה של המערכת המשולבת כולה.
הצוות מצא דרך לגזור את חיבורי ה- RNA בין המבנים המשתלבים, מבלי לפגוע בגדילי ה-RNA הקצרים החיוניים לביצוע ה"תפירה" הגנטית. כאשר הקפיאו את המבנים במהירות רבה בטמפרטורה נמוכה מאוד, עלה בידיהם לחקור כל אחד מהמבנים המשתלבים בפני עצמו, כשהוא נתון במצב קרוב מאוד למצבו הטבעי. כשבחנו את אלפי התמונות שהתקבלו בתהליך זה, שכל אחת מהן הציגה השלכה דו-ממדית של הספלייסוזום הטבעי בזווית מעט שונה, הצליחו המדענים להרכיב את תמונתו הכוללת והתלת-ממדית של "העורך הגנטי" בשלמותו.
ממצאי המחקר מראים, שהספלייסוזום בנוי משני חלקים לא שווים המקיפים מעין מנהרה. החלק הגדול מכיל חלבונים ואת הגדילים הקצרים של ה- RNA, והחלק הקטן מורכב מחלבונים בלבד. בצד אחד, המנהרה נפתחת למערה. המדענים משערים שחלל זה מתפקד כאיזור האיחסון של הקדם RNA שליח, שעדיין לא עבר את תהליך ה"תפירה" המתבצע בתוך המנהרה עצמה.
עדיין מוקדם לדעת אילו יישומים יתאפשרו הודות לתגלית החדשה. אבל מכיוון שברור שמחלות גנטיות ומחלות רבות אחרות נובעות מייצור חלבונים פגומים, כתוצאה משגיאות ומשיבושים בתהליכי העריכה הגנטית, נראה שהבנת התהליכים האלה פותחת אפשרויות חדשות לפיתוח תרופות ושיטות טיפול.