האגדה מספרת שנפוליאון בונפרטה, בין כל שאר תכונותיו הייחודיות, היה מסוגל לבצע שלוש מטלות בעת ובעונה אחת. בני אדם רגילים, לעומת זאת, מתקשים לבצע שתי מטלות יחד. ואכן, ככל שהדבר נוגע למולקולות חלבון, הדעה הרווחת בקרב מדענים, זה שנים, היא שכל מולקולה כזאת מוכשרת ומסוגלת לבצע פעולה מוגדרת אחת בלבד. אבל, בכל זאת, במשך השנים חזרה ועלתה השאלה, האם ייתכן שמולקולת חלבון כלשהי מסוגלת לבצע מגוון משימות. העובדה שהחלבונים מתאימים את עצמם לביצוע מטלות שונות עולה בראש ובראשונה מחישוב פשוט: גנום האדם כולל כ-40,000 גנים, הקובעים את הרצף הכימי את והמבנה המרחבי של החלבונים. אבל מספר התיפקודים שהחלבונים מבצעים כנראה גדול בהרבה מהמספר הזה. אחד ההסברים האפשריים לאי ההתאמה הזאת יכול להיות מבוסס על תהליך אבולוציוני, שבו החלבונים נוצרים בכל פעם מחדש בתצורה שונה, המתאימה אותם לביצוע משימות שונות. התהליך האבולוציוני הזה הוא נושא מחקריו של ד"ר דן תופיק מהמחלקה לכימיה ביולוגית במכון ויצמן למדע.
ד"ר תופיק: "אנחנו מכירים כיום כמה אנזימים חדשים שנוצרו בתהליך אבולוציוני שהתחולל בשנים האחרונות. אפשר לחשוב על כך כעל תהליך שמתחולל במולקולה שמותאמת לתפקיד אחד, אבל יש לה גם 'תחביב', או 'חלטורה', שהיא מסוגלת לבצע לעיתים רחוקות יחסית ובמידה לא רבה של יעילות. אבל, במשך הזמן, בתהליך אבולוציוני, היא עשויה לפתח את ה'תחביב' ולהפוך אותו ל'מקצוע' או לתחום עיסוק עיקרי".
המערכת החיסונית, למשל, היא מיקרוקוסמוס שבו מתחוללת אבולוציה ללא הרף. הנוגדנים, שהם אמצעי ה"גישוש" וה"הכרה" של המערכת, לומדים ללא הרף להכיר פולשים, מזהמים וגורמי מחלות חדשים. גם כאן קיימת התופעה של חלבונים מעטים המסוגלים לבצע מלאכות רבות: מספר סוגי הנוגדנים קטן בהרבה ממספרם העצום של האנטיגנים של הגורמים הזרים שעשויים לתקוף את הגוף. מדענים רבים התחבטו במשך שניםרבות בשאלה, כיצד יכול מגוון מוגבל של נוגדנים להכיר ולנטרל מספר כמעט לא מוגבל של אנטיגנים. בין אלה בלט לינוס פאולינג, שהציע שמולקולת נוגדן אחת יכולה "לאמץ" מספר גדול של מבנים, ובכך להתאים את עצמה לקשירת אנטי- גנים רבים (בכל פעם לאנטיגן אחר). כשהתברר המנגנון הגנטי של ייצור הנוגדנים, סברו רוב המדענים שפאולינג טעה בתפיסתו זו. אבל, שנים לאחר מכן הראו ג'פרסון פוט וסזר מילשטיין, שנוגדן אכן יכול לאמץ לעצמו צורות שונות. עבודה זו נתמכה, בין היתר, בעבודת דוקטורט של תלמיד מחקר צעיר במדרשת פיינברג של מכון ויצמן למדע: דורון לנצט (שהיה לימים לפרופ' מן המניין במכון וראש המרכז לחקר גנום האדם במכון). מנחהו של לנצט בעבודה זו היה פרופ' ישראל פכט ממכון ויצמן למדע. עבודת הדוקטורט הזאת הראתה, שנוגדנים שנוצרים בגוף מצויים במצב של שיווי משקל בין שתי צורות שונות (לפחות), מעין מצב של המתנה. רק כשהנוגדן נתקל באנטיגן, הוא מתאים את עצמו אליו. בטכניקות מדידה מתקדמות שפותחו בשנים האחרונות, כמו למשל שיטת המדידה הדינמית בתהודה מגנטית גרעינית שפיתח פרופ' לוסיו פרידמן ממכון ויצמן למדע (ראו "המכון" מספר 30), נצפו בפועל מולקולות של חלבונים המשנות את המבנה שלהן בעת שהן מבצעות את תפקידן.
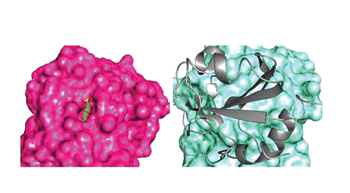
במחקר שביצעו באחרונה הצליחו ד"ר דן תופיק וד"ר ליאו ג'יימס לאשש את תחזיותיהם של פאולינג וממשיכיו, ולצפות בזמן אמיתי בשינויי מבנה שמתחוללים במולקולת חלבון בתוך אלפיות שנייה. מדובר בתהליך שבו נוגדן שהוכן על ידי פרופ' זליג אשחר ממכון ויצמן למדע משנה את צורתו כך שיתאים לקשירת אנטיגנים שונים. החוקרים גם פיענחו בפעם הראשונה את המבנה המרחבי של נוגדן כשהוא קשור בכל פעם למולקולה אחרת. נוגדן שמעוצב בצורה אחת קושר מולקולה של חלבון מורכב למדי. לאחר שהנוגדן שינה את צורתו, אתר קישור אחרהמצוי באיזור ההכרה שלו נקשר למולקולה סינתטית קטנה מסוימת. ממצאי המחקר הזה התפרסמו באחרונה בכתב העת המדעי SCIENCE . כל התהליך הזה מתחולל בקצה החיצוני של שתי זרועות הנוגדן, שהוא אתר ההכרה של הנוגדן. אתר זה, הקרוי FV, התגלה בשנות ה-60 על ידי פרופ' דוד גבעול ממכון ויצמן למדע.
ד"ר תופיק אומר, שיכולת שינוי המבנה של חלבונים, ובכללם נוגדנים, היא המקנה לחלבונים "גמישות תיפקודית" ויכולת התאמה אבולוציונית מהירה יותר. כך, למשל, מוקנית למערכת החיסונית היכולת לבלום באמצעות סוגים מעטים של "לוחמים" הרבה מאוד סוגים של פולשים, מזהמים וגורמי מחלות. ומצד שני, אותה יכולת עצמה היא זו העלולה לגרום לנוגדנים להיצמד ולתקוף מרכיבים החיוניים לגוף (דבר שמשמעותו עלולה להיות התפתחות מחלה אוטואימונית). זהו "תסריט האימים" כפי שתיאר אותו פאול ארליך. ואכן, תגלית זו של ד"ר תופיק שופכת אור חדש על דרכים אפשריות להתחוללותו של "תסריט האימים" ועל התפתחותן של מחלות אוטואימוניות. ייתכן שבעתיד היא תסייע בפיתוח דרכים מתקדמות למלחמה במחלות אלה.