אימרה הקובעת שככל שממדיו של העצם הנחקר קטנים יותר כך גדלים המכשירים הדרושים למחקר, נראית נכונה כשמביטים, מלמטה למעלה, אל ספק- טרומטר התהודה המגנטית גרעינית NMR, המותקן במעבדתו של פרופ' יעקב אנגליסטר מהמחלקה לביולוגיה מבנית במכון ויצמן למדע. באמצעות המכשיר הענק הזה, שגרם מדרגות מוביל אל ראשו, בוחן פרופ' אנגליסטר את המבנה המרחבי של מולקולות חלבוניות, ואת ההשפעה של המבנים האלה על תהליכים ביולוגיים ברמה המולקולרית וברזולוציה אטומית. "ה- NMR מאפשר לחקור את יחסי הגומלין שבין חלבונים שונים, דבר שמאפשר ללמוד על התיפקוד של המולקולות האלה במערכות ביולוגיות, כמו, למשל, בתוך גוף האדם", הוא אומר.
יחסי הגומלין המרתקים במיוחד את אנגליסטר ביותר הם אלו המתקיימים בין נוגדנים לאנטיגנים שלהם, ובמיוחד בין אנטיגן מסוים של נגיף ה- HIV (הגורם לתסמונת הכשל החיסוני הנרכש - AIDS), לבין נוגדנים המסוגלים לנטרל ולבלום את הנגיף. בשלב הראשון של תהליך ההדבקה נקשר נגיף ה- HIV לשני קולטנים שונים הממוקמים על קרומיהם של תאי המערכת החיסונית (מקרופגים ותאי T). הקשירה הזו מבוצעת באמצעות חלבון המצוי על מעטפת הנגיף, וקרוי gp120. בתחילה נקשר החלבון הזה לקולטן מסוג cd4 ולאחר מכן לקולטן לכימוקינים, שהם מולקולות המהוות מעין "שליחים כימיים" המאפשרים תקשורת בין מרכיבים שונים של המערכת החיסונית. רק לאחר שחלבון מעטפת הנגיף נקשר לקולטן האנושי השני (הקולטן לכימוקינים), מתחוללים בחלבון המעטפת של הנגיף שינויים מבניים - תהליך שמאפשר לנגיף לחדור אל תוך תא המטרה.
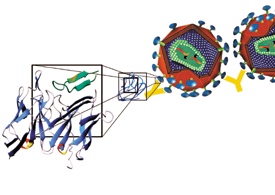
הנוגדנים שחוקר פרופ' אנגליסטר מונעים אתקשירת חלבון המעטפת הנגיפי gp120 אל הקולטן האנושי השני, ובכך הם בולמים את תהליך חדירתו של הנגיף אל תוך תאי האדם. נוגדנים אלה מזהים ונצמדים למרכיב מסוים של החלבון הנגיפי gp120, הקרוי לולאת gp120 וממלא תפקיד מרכזי בתהליך הקשירה של הנגיף אל הקולטן לכימוקינים הממוקם על קרומיהם של תאי המערכת החיסונית - מקרופגים ותאי T בגוף האדם.
הבעיה היא שהנגיף מתחמק מהנוגדנים האלה באמצעות שינויים גנטיים (מוטציות) שמתחוללות בו בקצב מהיר, דבר שמשנה ללא הרף את מבנה הלולאה. זנים מסוימים של הנגיף אף נוהגים להסתיר את אזור לולאת V3 עד לשלב האחרון של הקישור. במקרה זה לא מיוצרים נוגדנים נגד האזור החיוני. מפליא לגלות שהנגיף מסוגל להשתמש בלולאת V3 לקישור, ובו בזמן לגרום בה מוטציות שיאפשרו לו להימלט מנוגדני המערכת החיסונית. מחקרו של פרופ' אנגליסטר מספק את פרטי המבנה של פני השטח של לולאת V3, ובכך גם חלק מהתשובה לשאלה מורכבת זו.
כך התגלה, כי חלק מהלולאה יוצר שטח המורכב משיירים שמורים באבולוציה (עובדה המרמזת על חשיבותם להישרדות הנגיף). ואכן, נמצא כי הם מעורבים בקישור לקולטן האנושי המיועד לקליטת כימוקינים. לידם מצוי משטח נוסף המורכב משיירים העוברים שינויים גנטיים תכופים. שיירים אלה, המשתנים במהירות, חשופים על פני החלבון, כך שהמערכת החיסונית האנושית יוצרת נגדם נוגדנים, אלא שבשל השינויים המבניים המהירים אין לנוגדנים האלה שהות מספיקה לפעול. למעשה, גם אם המערכת החיסונית יוצרת נוגדנים המתאימים בחלקם למרכיבים השמורים באבולוציה של הלולאה, עדיין השינויים המהירים במרכיבים שאינם שמורים מסכלים את פעילותם של הנוגדנים.
חיסון המושתת על פפטידים סינתטיים עשוי להיות חלק מהפתרון למצב מורכב זה, כפי שהראו בעבר פרופ' מיכאל סלע ופרופ' רות ארנון, שחקרו מחלות שונות הקשורות למערכת החיסונית. מתברר שפפטידים סינתטיים עשויים לעודד את המערכת החיסונית ליצירת נוגדנים נגד מרכיבים נגיפיים המוסתרים רוב הזמן, דוגמת לולאת V3. קוקטייל של פפטידים המייצגים את הרצף של הזנים העיקריים של HIV עשוי לפתור את בעיית השינויים הגנטיים המהירים המתחוללים בנגיף החמקן. "אנו מקווים שאפשר יהיה להשתמש במבנה ה- V3 לתכנון נוגדן טוב יותר לנגיף ה- HIV", אומר פרופ' אנגליסטר. "קבוצת מחקר אמריקאית סיפקה לנו נוגדן שנוצר בגופו של חולה מסוים, המסוגל לזהות ולפעול נגד זנים שונים של הנגיף שעברו מוטציות בלולאה V3. באמצעות ה- NMR אנחנו מקווים לגלות מה מעניק לנוגדן הזה את היכולת הבלתי רגילה הזאת. ידע זה עשוי לסייע בתכנון קוקטייל פפטידים יעיל יותר לשימוש בתרכיב חיסון נגד נגיף ה- HIV".