אהבה היא אחת התופעות המסתוריות ביקום. כיצד נפש אחת מוצאת את "אחותה התאומה" בהמון רב? את התעלומה הזאת נפתור, אולי, בעוד שנים רבות מאוד, אבל על תופעות דומות המתחוללות בעולם המולקולרי ייתכן שנדע יותר בעתיד הנראה לעין. מדובר באחת מתופעות החיים הבסיסיות ביותר: מולקולה חלבונית אחת "מזהה" מולקולה חלבונית אחרת ונקשרת אליה. איך הן עושות זאת? ד"ר גדעון שרייבר, מהמחלקה לכימיה ביולוגית במכון ויצמן למדע, וחברי קבוצת המחקר שהוא עומד בראשה, מנסים למצוא תשובה לשאלה הבסיסית הזאת. הם פיתחו אלגוריתם (מתכון פעולה ממוחשב) המסוגל לחזות במידה טובה של דיוק את קצב ההיצמדות של מולקולות חלבוניות מסוימות. אלגוריתם זה תואר במאמר שפירסמו ד"ר שרייבר וחברי קבוצתו בכתב העת המדעי "נייצ'ר סטרוקטורל ביולוג'י".
תחזית ממוחשבת זו מאפשרת למדענים לבצע במולקולות החלבוניות שינויים מבניים שונים המגבירים את המשיכה הבין-מולקולרית עד פי מאה ויותר (מאה שערים). תצמידים של מולקולות חלבון עשויים להידרש לתעשיית התרופות, לתעשיית המזון וליישומים נוספים, ולפיכך נודעת חשיבות רבה למידת היעילות והמהירות שבהן אפשר להפיק אותם. כדי לעשות זאת אפשר לנקוט שתי דרכים: להגביר את מהירות ההיווצרות של התצמידים, או להפחית את קצב ההתפרקות שלהם. מחקריו הנוכחיים של ד"ר שרייבר מכוונים לדרך הפעולה הראשונה: הגברת קצב היווצרות התצמידים באמצעות בחירת המולקולות בעלות עוצמת המשיכה ההדדית הגדולה ביותר.
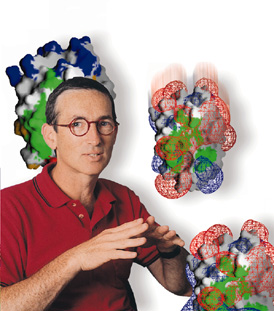
עוצמת "המשיכה ההדדית" בין שתי מולקולות חלבון מוגדרת כיחס שבין קצב היצמדותן זו לזו, לבין קצב ההיפרדות של התצמידים המולקולריים הכוללים את שתיהן. קצב ההיצמדות תלוי בין היתר במבנה המרחבי התלת-ממדי של המולקולות, הנקבע בעיקר על ידי הרצף הגנטי. התלות הזאת, בין המבנה המרחבי לקצב היצמדות המולקולות, היא הבסיס לאלגוריתם החדש שפיתחו ד"ר שרייבר ותלמידת המחקר צביה זלצר. אלגוריתם זה מסוגל לחשב ולנבא בדיוק רב אילו שינויים ברצף הגנטי יובילו להיצמדות המולקולרית המהירה ביותר.
ד"ר שרייבר: "אפשר לנסות את כל המבנים האפשריים בזה אחר זה, וכך לגלות מי מהם מוביל להיצמדות המהירה ביותר. אבל לעתים מדובר במיליוני אפשרויות, דבר שאינו מאפשר לבחון את כולן בניסוי. הרבה יותר מעשי, זול, מהיר ופשוט לעשות זאת באמצעות המחשב". בניסוי שביצעו החוקרים על פי ניבויי האלגוריתם, עלה בידם להגביר פי 250 את קצב היווצרותו של תצמיד בין שני חלבונים (בתא לקטמז והחלבון המעכב אותו), ובעת ובעונה אחת אף לחזק אותו במידה ניכרת.
שיטת פעולה זו עשויה לסייע בפיתוח תרופות חדשות, שיעודדו או יבלמו את פעילותם של חלבונים שונים, וכן בפיתוח מערכות שונות - מהירות ויעילות במיוחד - לאיבחון רפואי.