בקרום של כמעט כל תא בגופנו ממוקמות אלפי - ולעיתים מיליוני - משאבות זעירות העובדות קשה כדי להחזיק אותנו בחיים. בלעדיהן פשוט לא היינו שורדים. אך על אף העובדה שהן נמנות עם החלבונים החיוניים ביותר בשבילנו, רק מעט ידוע לנו על המבנה ועל מנגנוני הבקרה של משאבות מולקולריות אלה.
"המשאבות שולטות באיזון המלחים בגופנו, ופגיעה או הפרעה לפעילותן התקינה עלולה להוביל להתפתחות מחלות שונות", אומר פרופ' סטיבן קרליש מהמחלקה לכימיה ביולוגית במכון ויצמן למדע, המתמקד באתגר של חקר המשאבות.
תפקידן העיקרי של המשאבות שחוקר פרופ' קרליש הוא לשלוט במאזן המלח והמים בתאים, באמצעות ויסות הריכוזים של יוני נתרן ואשלגן בתוך התאים ובסביבם. כתוצאה מפעילותן נוצר בתוך התא ריכוז נמוך יותר של יוני נתרן בהשוואה לריכוז הגבוה יותר שמתקיים מחוץ לתא. באשר ליוני האשלגן, מגמת הפעילות של המשאבות הפוכה: הן יוצרות ריכוז גבוה יותר של יוני אשלגן בתוך התא, בהשוואה לריכוז נמוך יותר המתקיים מחוצה לו. כלומר, המשאבות מנהלות מעין "תוכנית חילופין" בין יונים של נתרן ליוני אשלגן. מכיוון שהתנועה בכיוון הרצוי מנוגדת ל"רצון הטבעי" של היונים, יש להשקיע אנרגיה ולהעניק להם דחיפה באמצעות המשאבות. הפרעות בתהליך זה יכולות להוביל להתפתחות מחלות כגון לחץ דם גבוה, דבר שעלול לגרום מחלת לב, מחלות כליות ושבץ מוחי. לפיכך, טיפולים תרופתיים שונים עשויים להתבסס על השפעה על פעילות המשאבות.
לדוגמה, קבוצת תרופות הדומות לסטרואידים, המופקות מצמח האצבעונית, והקרויות דיגיטליס, והמשמשות יותר מ-200 שנה לטיפול במחלות לב, מעכבות את משאבת הנתרן-אשלגן, ומגבירות את עוצמת פעימות הלב. למעשה, גוף האדם מייצר חומרים דומים לדיגיטליס, החשובים לשליטה בלחץ דם. אבל, בלימת יתר של פעילות המשאבות עלולה להיות מסוכנת, ולכן המדענים מחפשים כיום תרופות בטוחות יותר. כדי לפתח תרופות כאלה יש לפענח את המבנה המולקולרי של המשאבות.
את המטרה הזאת קשה להשיג בעיקר מפני שקשה להפיק כמויות מספיקות של חלבון המשאבה, הנחוצות ליצירת גביש טהור של חלבון (שלב הכרחי בפיענוח מבנה מולקולרי בטכניקה של קריסטלוגרפיה בקרני X). כדי לעקוף את הקושי הזה, ולהגיע למטרה בדרך אחרת, פיתחו באחרונה פרופ' קרליש וחברי קבוצת המחקר שלו גישה חדשה. הם עשו זאת באמצעות סוג מסוים של שמרים הקרויים Pichia pastoris, המבטאים כמויות גדולות של חלבון המשאבה. השימוש בתאי שמר אלה מאפשר לבדד כמויות גדולות של חלבון המשאבה. תוצאות המחקר הזה פורסמו בכתב העת המדעי Journal of Biological Chemistry. כעת מנסים המדענים ליצור גבישים של החלבון.
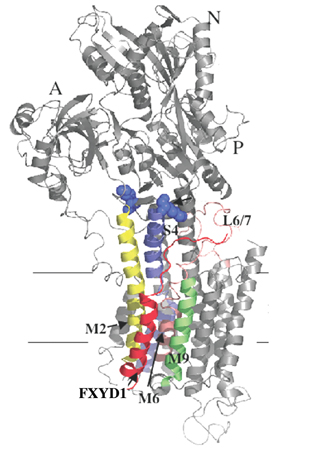
עד כה ידעו המדענים, שמשאבות הנתרן-אשלגן בנויות משתי יחידות, אלפא ובטא, הקיימות במספר "טעמים", תלוי בסוג התא. סוג אחד של יחידת אלפא נמצא בכל סוגי התאים, וסוגים אחרים, מיוחדים, נמצאים בדרך כלל בשרירי השלד והלב, במוח ובאשכים. יש הבדלים קטנים במבנה ובתפקוד בין הסוגים השונים של יחידות האלפא. עד עכשיו הצליחו פרופ' קרליש ושותפיו למחקר לבודד שני סוגים שונים של מבנים משולבים הכוללים יחידות אלפא ובטא יחד.
הפעילות של משאבת הנתרן-אשלגן חייבת להיות מבוקרת בדייקנות. כדי לחקור את תהליכי הבקרה האלה, חברה קבוצת המחקר של פרופ' קרליש לקבוצת המחקר של פרופ' חיים גרטי, מהמחלקה לכימיה ביולוגית במכון ויצמן למדע. יחד, עלה בידם לתאר את הקשר המבני והתפקודי בין המשאבה לבין קבוצה המונה שבעה חלבונים הקרויים FXYD. ממצאי המחקר הזה, שפורסמו בכתבי העת המדעיים Journal of Biological Chemistry ו- Annual Review of Physiology, הראו שחלבוני ה-FXYD מתפקדים כמעין תת-יחידות נוספות של המשאבה. כל אחד משבעת החלבונים פועל כחלק ממנגנון של "תיבת הילוכים" מולקולרית השולטת בתכונות תפקודיות מסוימות של משאבת הנתרן-אשלגן - ומתאים את תכונותיה של המשאבה לדרישותיהן של רקמות שונות שבהן ממוקמות המשאבות.
בידוד החלבון ובירור המבנה של המשאבה עשוי לאפשר הבנה טובה יותר של פעולת המשאבה ושל מנגנוני השליטה של חלבוני ה-FXYD. הבנה זו עשויה להוביל לפיתוח תרופות בטוחות יותר שיפעלו באופן ממוקד על משאבות המצויות רק בלב, ובכך יפחיתו במידה רבה את השפעות הלוואי הבלתי-רצויות.
במחקר השתתפו: החוקרים הבתר-דוקטוריאליים ד"ר איתן כהן ומריה פוסזי מהמחלקה לכימיה ביולוגית ומושית לינדזן מהמחלקה לבקרה ביולוגית, תלמידי המחקר יעל ליפשיץ, טליה בלוגוס, חיים חביב וליזה דיניץ, תלמיד המחקר דאז ד"ר דויד סטרוגצקי מהמחלקה לכימיה ביולוגית, וכן ד"ר דניאל טל ורבקה גולדשלגר.