פירוק חלבונים פגומים, או חלבונים שסיימו את תפקידם, נעשה באמצעות תהליך "ביורוקרטי" מסודר ומבוקר, שבו מסומנים החלבונים המועמדים לפירוק בתווית מיוחדת – יובקוויטין – ומועברים אל "האגף לפירוק חלבונים", הפרוטאוסום. לאחר זיהוי התווית – שנעשה באמצעות יחידה מסוימת של הפרוטאוסום – נכנס החלבון ליחידה אחרת, המתפקדת כ"מגרסה", שם הוא מתפרק למרכיביו. אולם מלבד התהליך ה"ביורוקרטי", שגילויו זיכה את רוז, הרשקו וצ'חנובר בפרס נובל בכימיה לשנת 2004, הולכת ומתבהרת בשנים האחרונות חשיבותו של תהליך פירוק נוסף, פסיבי ו"ספונטני" יותר. מתברר, כי חלבונים מסוימים – שהם חסרי מבנה מקופל ומסודר, במלואם או בחלקם – יכולים למצוא את דרכם לתוך המגרסה מבלי שעברו את שלבי הסימון והזיהוי. זהו אינו תהליך שולי: כמעט שליש מהחלבונים בתא כוללים מקטעים לא מקופלים, ובהם גם חלבונים חשובים לתיפקוד התא, הממלאים תפקידי בקרה והעברת אותות. למעשה, חמישית מכלל חלבוני התא מפורקים באופן זה. לכאורה, מדובר ב"שואב אבק" יעיל, אשר שומר על סדר וניקיון בתא. אך כיצד מונעים ממנו לשאוב את כל הנקרה על דרכו? שאלה זו מסובך לחקור – משום ששני המסלולים, ה"ביורוקרטי" והפסיבי, מתקיימים זה לצד זה בתא.
לפני מספר שנים גילה
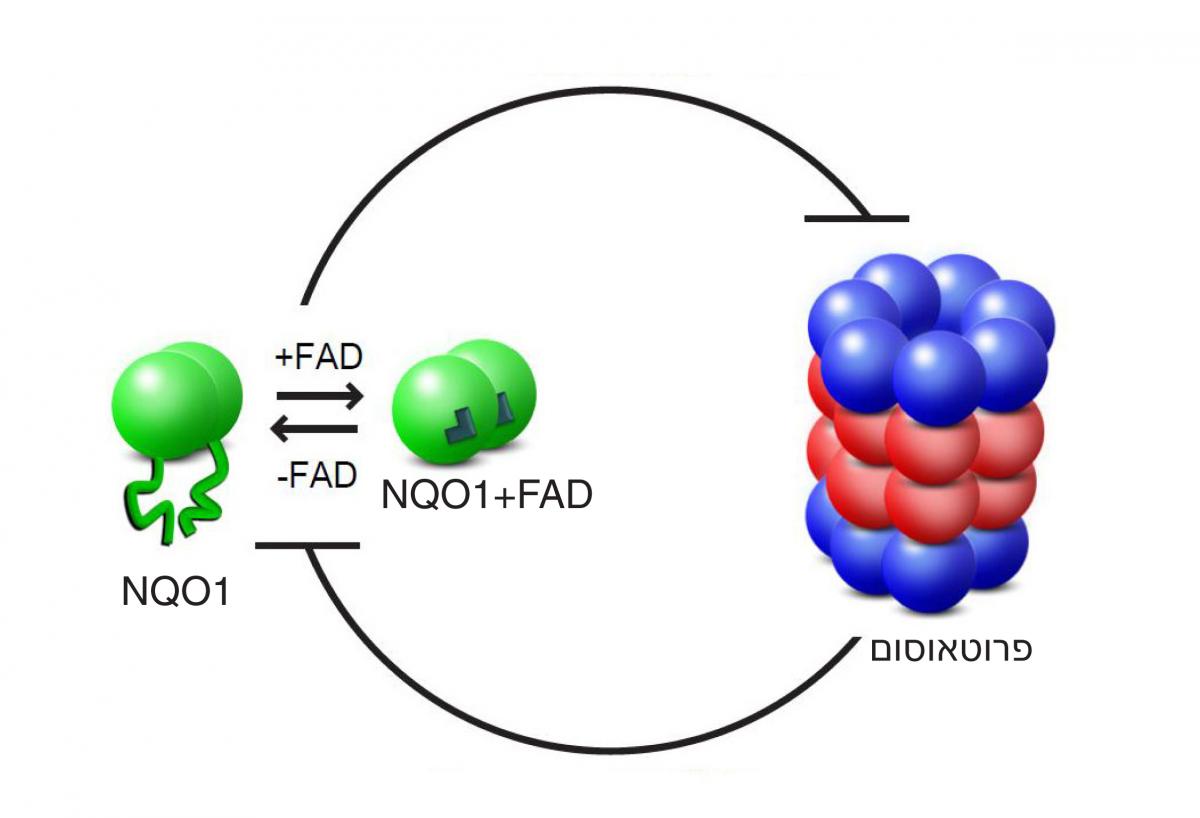
פרופ' יוסף שאול, ראש המחלקה לגנטיקה מולקולרית במכון, רמז ראשון לתשובה: הוא זיהה את ה"מציל", אשר מונע פירוק לא רצוי של חלבונים בפרוטאוסום. מדובר באנזים הקרוי NQO1, אשר מנהל חיים כפולים: הוא נלחם בתרכובות חמצן פעילות, וכך מגן על התא מפני עקה חימצונית, ובנוסף, הוא גם מגן על חלבונים חיוניים מפני פירוק. כיצד בדיוק הוא עושה זאת? שאלה זו עמדה במרכז המחקר הנוכחי, שביצעו אורן מוסקוביץ, נמרוד חזן, הודיה קיסר, גילי בן ניסן, וד"ר יצחק מיכאלבסקי מקבוצתה של ד"ר שרון. כדי לחקור לעומק את יחסי הגומלין בין האנזים NQO1 לבין הפרוטאוסום במסלול הפירוק הפסיבי, יצרו המדענים מערכת ניסוי מלאכותית, שלתוכה הכניסו את האנזים ואת יחידת ה"מגרסה" של הפרוטאוסום בלבד – ללא היחידה שאחראית לזיהוי תווית היוביקוויטין. כך עלה בידם לבודד ולחקור את המסלול הרצוי. הגורם השלישי שהוסיפו המדענים למערכת הוא מולקולה שמקורה בוויטמין B
2, הקרויה FAD. קשירה של שתי מולקולות FAD לאנזים המורכב משתי יחידות של NQO1 היא שמאפשרת לו לבצע את תפקידיו בתא.
בדיקת האנזים NQO1
בשיטות של ספקטרומטריית מאסות גילתה, שקשירת המולקולות FAD מייצבת את המבנה המרחבי שלו. כאשר בדקו המדענים צורה נוספת של האנזים, שבה אתר הקישור ל-FAD הוא פגום, וכן כאשר הסירו את מולקולות FAD מאנזים תקין, נוצר אנזים חסר צורה, שאינו מסוגל להתקפל למבנה מסודר. בהמשך התגלה, כי אנזימים חסרי צורה אלה מפורקים בפרוטאוסום, ו"נעלמים" ממערכת הניסוי. לעומת זאת, כאשר הוסיפו המדענים למערכת הניסוי כמויות גדולות של FAD, הם הצליחו להחזיר לאנזימים – הרגיל והמוטנטי – את צורתם, וכך להצילם מפירוק.
מחקר בתאים חיים, שנעשה בשיתוף עם פרופ' יוסף שאול ועם תלמיד המחקר מקבוצתו, פטר צבקוב, הרחיב את התמונה. מתן ויטמין B2 לתאים אנושיים הוביל לא רק לעלייה ברמת ה-NQO1 ולייצוב המבנה שלו, אלא גם לעלייה ברמת p53. תמונה דומה התקבלה בבדיקת תאי סרטן שד, שאינם מכילים את האנזים בגלל הפגם בקשירת FAD. הוספת B2 לתאים אלה הצליחה להציל את NQO1, וכך איפשרה לו להציל את p53.
ממצאי המחקר, שהתפרסמו באחרונה בכתב-העת המדעי
Molecular Cell, מגלים כי יחסי הגומלין בין הפרוטאוסום לבין NQO1 מבוססים על עיכוב הדדי: הפרוטאוסום מפרק אנזימי NQO1 חסרי מבנה, ואילו האנזים "חוסם בגופו" את הפעילות ההרסנית של הפרוטאוסום,ובדרך זה מציל מפירוק לא רק את עצמו, אלא גם חלבונים אחרים. מרכיב חשוב בבקרה ההדדית הזו הוא גורם תזונתי חיצוני – ויטמין B
2, אשר משפיע על מבנה האנזים, וכך שולט בתיפקודו. המדענים סבורים, כי ייתכן שהתופעה שגילו, כלומר שגורם מטבולי משפיע על תיפקוד מערכת באמצעות השפעה על המבנה, אינה ייחודית למסלול שחקרו.
המוטציה אשר פוגעת ביכולתו של NQO1 לקשור FAD, ששכיחותה בקרב בני אדם לבנים עומדת על כ-4%, קיימת בחמישית מהאוכלוסייה האסיאתית. המוטציה גורמת לכך שהתאים אינם מסוגלים להתמודד היטב עם עקה חימצונית, ומכילים רמות נמוכות של p53 ו-p73, ולכן הם פגיעים לסרטן – במיוחד לסרטן השד וללוקמיה. ממצאי המחקר רומזים על חשיבותו התזונתית של ויטמין B2, ובפרט אצל אנשים הסובלים מהמוטציה.
 פירוק חלבונים פגומים, או חלבונים שסיימו את תפקידם, נעשה באמצעות תהליך "ביורוקרטי" מסודר ומבוקר, שבו מסומנים החלבונים המועמדים לפירוק בתווית מיוחדת – יובקוויטין – ומועברים אל "האגף לפירוק חלבונים", הפרוטאוסום. לאחר זיהוי התווית – שנעשה באמצעות יחידה מסוימת של הפרוטאוסום – נכנס החלבון ליחידה אחרת, המתפקדת כ"מגרסה", שם הוא מתפרק למרכיביו. אולם מלבד התהליך ה"ביורוקרטי", שגילויו זיכה את רוז, הרשקו וצ'חנובר בפרס נובל בכימיה לשנת 2004, הולכת ומתבהרת בשנים האחרונות חשיבותו של תהליך פירוק נוסף, פסיבי ו"ספונטני" יותר. מתברר, כי חלבונים מסוימים – שהם חסרי מבנה מקופל ומסודר, במלואם או בחלקם – יכולים למצוא את דרכם לתוך המגרסה מבלי שעברו את שלבי הסימון והזיהוי. זהו אינו תהליך שולי: כמעט שליש מהחלבונים בתא כוללים מקטעים לא מקופלים, ובהם גם חלבונים חשובים לתיפקוד התא, הממלאים תפקידי בקרה והעברת אותות. למעשה, חמישית מכלל חלבוני התא מפורקים באופן זה. לכאורה, מדובר ב"שואב אבק" יעיל, אשר שומר על סדר וניקיון בתא. אך כיצד מונעים ממנו לשאוב את כל הנקרה על דרכו? שאלה זו מסובך לחקור – משום ששני המסלולים, ה"ביורוקרטי" והפסיבי, מתקיימים זה לצד זה בתא.
פירוק חלבונים פגומים, או חלבונים שסיימו את תפקידם, נעשה באמצעות תהליך "ביורוקרטי" מסודר ומבוקר, שבו מסומנים החלבונים המועמדים לפירוק בתווית מיוחדת – יובקוויטין – ומועברים אל "האגף לפירוק חלבונים", הפרוטאוסום. לאחר זיהוי התווית – שנעשה באמצעות יחידה מסוימת של הפרוטאוסום – נכנס החלבון ליחידה אחרת, המתפקדת כ"מגרסה", שם הוא מתפרק למרכיביו. אולם מלבד התהליך ה"ביורוקרטי", שגילויו זיכה את רוז, הרשקו וצ'חנובר בפרס נובל בכימיה לשנת 2004, הולכת ומתבהרת בשנים האחרונות חשיבותו של תהליך פירוק נוסף, פסיבי ו"ספונטני" יותר. מתברר, כי חלבונים מסוימים – שהם חסרי מבנה מקופל ומסודר, במלואם או בחלקם – יכולים למצוא את דרכם לתוך המגרסה מבלי שעברו את שלבי הסימון והזיהוי. זהו אינו תהליך שולי: כמעט שליש מהחלבונים בתא כוללים מקטעים לא מקופלים, ובהם גם חלבונים חשובים לתיפקוד התא, הממלאים תפקידי בקרה והעברת אותות. למעשה, חמישית מכלל חלבוני התא מפורקים באופן זה. לכאורה, מדובר ב"שואב אבק" יעיל, אשר שומר על סדר וניקיון בתא. אך כיצד מונעים ממנו לשאוב את כל הנקרה על דרכו? שאלה זו מסובך לחקור – משום ששני המסלולים, ה"ביורוקרטי" והפסיבי, מתקיימים זה לצד זה בתא.