עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
הירשמו לניוזלטר החודשי שלנו:
במחלת אלצהיימר, מתחוללים תהליכים פתולוגיים הגורמים להפחתה ניכרת בתפקוד המוח. בתוך תאי המוח, וביניהם, מצטברים צברים של חלבון עמילואיד-בטא ("פלאקים"), שאמורים להיות מסולקים. בנוסף לכך, חלבוני השלד של שלוחות תאי העצב מאבדים את מבנם התקין, דבר שפוגע בתפקודם וגורם למותם. כמו כן צמתי התקשורת העצבית (סינפסות) נחלשים, הן בשל שינויים מבניים, והן בשל היחלשות מסלולים של תקשורת כימית.
שאלה מרכזית בתחום מחלות המוח הניווניות, היא מדוע תאים חיסוניים, המצויים דרך קבע במוח וקרויים מיקרוגליה, לא נכנסים לפעולה ומתקנים את הנזקים? תאי המיקרוגליה אמורים לפרק ולפנות שברי תאים וחומרים שונים שאינם מתפקדים כראוי. עם זאת, פעילותם של תאים אלה נעשית תחת בקרה קפדנית, כדי לאפשר להם לסלק פסולת מבלי לפגוע בתאי העצב הבריאים שאוצרים מידע חשוב. המנעד הזה, בין פעילות חיסונית הכרחית לבין סכנה שפעילות-יתר תפגע בתאי עצב בריאים, גרם לכך שלתאים אלה יוחסה השפעה שלילית בכל מקרה של דלקת מקומית אשר מתפתחת במחלות ניווניות כמו אלצהיימר ואחרות.
תפיסה זו הובילה מדענים רבים לפרש את תופעת הדלקת המקומית במוח, הנלווית למחלת אלצהיימר, כתופעה שלילית הנגרמת מפעילות תוקפנית מדי של תאי המיקרוגליה, אשר נובעת מתקלה במנגנוני הוויסות שלהם, או מכניסה לא מבוקרת של תאים חיסוניים מהדם למוח. לפיכך, נוסו בתחום זה טיפולים נוגדי דלקת. ניסויים אלו לא צלחו והותירו את המדענים בתחום עם השאלה של תפקוד התאים החיסוניים במחלות ניווניות במוח.
פרופ' מיכל שוורץ מהמחלקה לנוירוביולוגיה במכון ויצמן למדע, הראתה במשך השנים כי גיוס תאים מהמערכת החיסונית הפריפרית, לא רק שאינו מזיק, אלא אף מסייע להתמודדות עם מחלת אלצהיימר – בתנאי שהוא מבוקר. ולכן השאלה של תפקיד תאי החיסון של המוח עצמו, תאי המיקרוגליה, נשארה פתוחה: האם הם מועילים? חסרי תועלת? או מזיקים?
פרופ' שוורץ יחד עם פרופ' עידו עמית מהמחלקה לאימונולוגיה במכון ויצמן למדע, וחברי קבוצות המחקר שלהם, החוקרים הבתר-דוקטוריאליים ד"ר הדס קרן שאול וד"ר אסף ויינר, ותלמידי המחקר עמית ספינרד, אורית מטקוביץ ורז דביר, מציעים עכשיו תשובה לשאלה זו, כשלצידה כיוון מחקר חדש לפיתוח דרכי טיפול במחלה.
מדובר בתפיסה חדשה בהבנת ההתמודדות עם מחלת אלצהיימר, המבוססת על הבנה של התפקיד המרכזי של תאי המיקרוגליה במחלה, ועל התובנה שמנגנוני הריסון של תאים אלה, החשובים לתפקוד תקין, הופכים להיות מכשול במוח החולה"

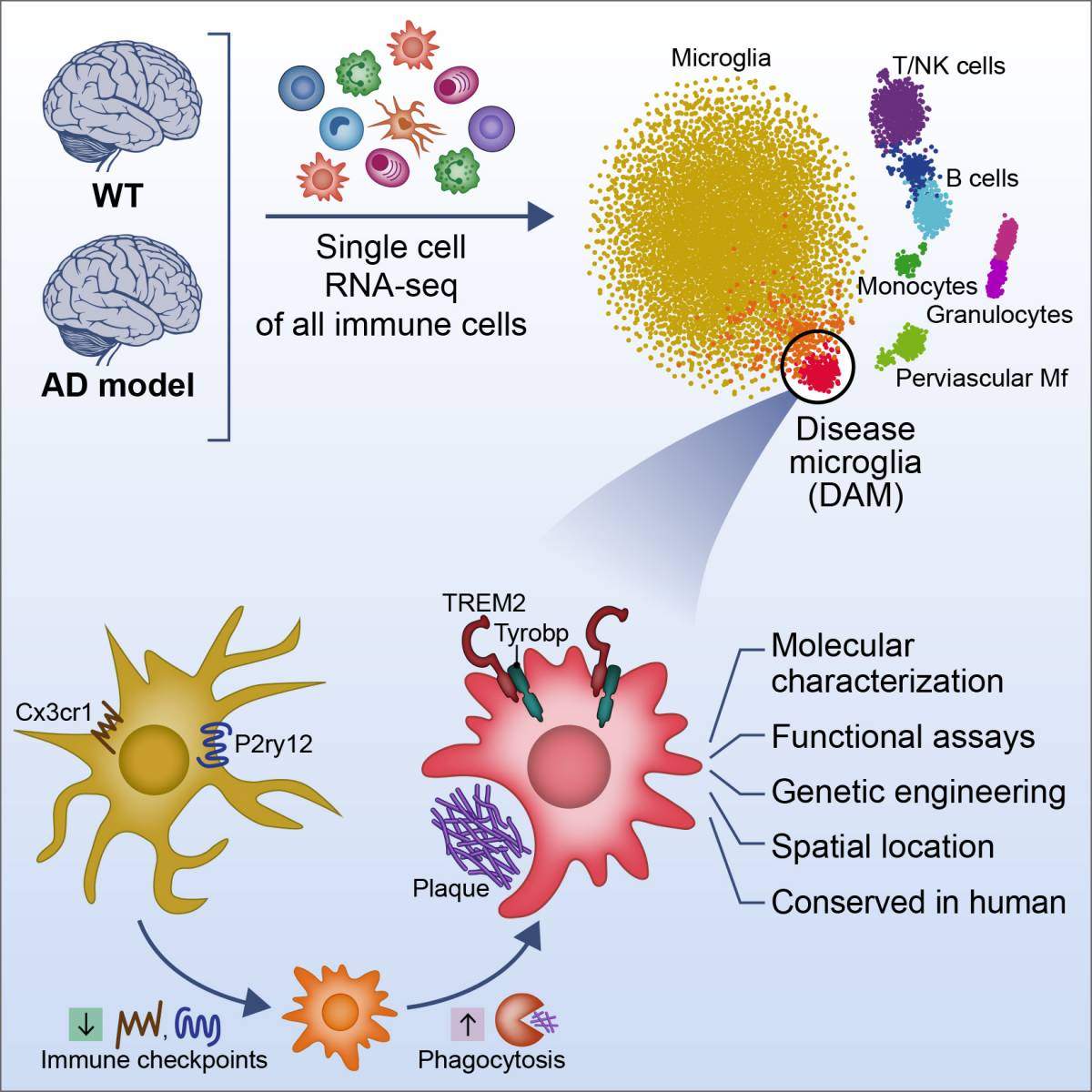
המדענים בחנו עכברים מהונדסים גנטית, שמהווים מודל מחקרי למחלת אלצהיימר ואשר במטען הגנטי שלהם משולבים חמישה גנים אנושיים מוטנטיים, שהם בין הגורמים הגנטיים שזוהו כאחראים להתפתחות המחלה. במוחותיהם של עכברים אלה מתרחשות תופעות הדומות לאלה שמתחוללות במחלת אלצהיימר בבני-אדם. מכשול משמעותי בהבנת תפקידי התאים החיסוניים במחלת אלצהיימר, ובמחלות מוח ניווניות אחרות, הוא היכולת להפריד באופן מדויק בין תאים לכאורה דומים, בעלי תפקודיות שונה, ומכאן, להבין מי "ידיד" ומי "אויב". המדענים השתמשו בטכנולוגיה מתקדמת של ריצוף חומר גנטי של תאים בודדים, מעין "מיקרוסקופ גנטי״, שפותחה בשנים האחרונות במעבדתו של פרופ' עמית, המאפשרת לבצע ריצוף גנטי מלא של תאים בודדים – וכך לזהות את תפקודם הייחודי של תאים חיסוניים, גם אם הם נדירים.
במחקר זה ריצפו המדענים את תכולת האר-אן-אי של כל התאים החיסוניים במוחם של עכברי הניסוי (תהליך שאי-אפשר היה לבצעו עד לפני זמן קצר מאוד). הם חזרו על תהליך הריצוף הזה, בנקודות זמן שונות, לאורך כל שלבי התפתחות המחלה, והשוו את התוצאות לעכברי ביקורת בריאים. בדרך זו עלה בידיהם לזהות תת-קבוצה של תאי מיקרוגליה ייחודיים, שאינם מצויים בעכברים בריאים, ואשר משתנים בהדרגה, עם התקדמות המחלה. תאים אלו כונו disease-associated microglia (DAM). בהמשך המחקר נמצא כי תאים אלה מבטאים חלבונים המזהים את תוצרי הנזקים שנגרמים במחלת אלצהיימר, ומפרקים את ה"פלאקים".
עוד נמצא כי התפתחות תאים ייחודיים אלה תלויה בשני מנגנונים: בהפחתה בביטוי של חלבוני הבקרה (checkpoints) שמרסנים את פעילות המיקרוגליה במוח הבריא, ובהפעלת מבנה חלבונים שמזהה הצטברות של ליפידים זרים (מולקולות דמויות שומן) ותאים מתים, בהם חלבון הנקרא TREM2. בחולי אלצהיימר, מוטציה בחלבון זה מלווה במחלה שמתפתחת מוקדם ובאופן סוער יותר. כשהמדענים בודדו תאי מיקרוגליה ממוחם של עכברי מודל לאלצהיימר שהונדסו כך שלא יוכלו לבטא את TREM2 (עבודה זו בוצעה בשיתוף פעולה עם פרופ' מרקו קולונה מאוניברסיטת סנט לואיס), לא הצליחו תאי המיקרוגליה להתפתח לתאי DAM ולסלק את ה"פלאקים". בבחינת מוחות של עכברי מודל לאלצהיימר, וכן של בני-אדם שחלו באלצהיימר, נמצא שאותם תאים ייחודיים ממוקמים בסמיכות לאזורי ה"פלאקים", דבר שמעיד על הקשר בין מנגנון הפעלתם לפעילותם. למעשה, התאים הייחודיים האלה מבטאים חלבונים שכבר אובחנו בעבר בחולי אלצהיימר כ"חלבוני סיכון" במחלה. במלים אחרות, תאים אלו מבטאים חלבונים שמוטציות בהם גורמות לאי-תפקוד התאים, ולכן מלוות במחלה חריפה יותר.
"מערך ממצאים זה", אומר פרופ' עמית, "מוביל אותנו להבנה שהפחתת הביטוי של חלבוני הריסון דרושה להגברה מספיקה של מסלולי השיפעול של התאים הייחודים שזיהינו, כדי שיוכלו לבצע את מלאכת סילוק הפלאק".
מוסיפה פרופ' שוורץ: "מדובר בתפיסה חדשה בהבנת ההתמודדות עם מחלת אלצהיימר, המבוססת על הבנה של התפקיד המרכזי של תאי המיקרוגליה במחלה, ועל התובנה שמנגנוני הריסון (checkpoints) של תאי המיקרוגליה, החשובים לתפקוד תקין, הופכים להיות מכשול במוח החולה".
תגליות אלו מסמנות מטרה אפשרית חדשה לטיפול במחלה: תרופה שאולי תפותח בעתיד, ואשר תגרום להפחתת הביטוי של חלבוני הבקרה בקבוצת התאים הייחודית שזיהו המדענים; תביא להתגברות הביטוי של מסלולי התיקון – דבר שעשוי להאיץ את תהליך ההתפתחות של תאים אלה, ולהגביר את יעילותם בסילוק "פלאק" מהמוח – וכך תפחית אולי תסמינים שונים של המחלה.
מוסיפה החוקרת הבתר-דוקטוריאלית ד"ר הדס קרן שאול, שהייתה אחת ממובילי המחקר: "בשלב זה אנו חוקרים דרכים שונות להפעלה מיטבית של תאי המיקרוגליה". אתגר זה עומד במרכז מחקריהם העכשוויים של קבוצות מחקר אלה.
לקבלת מידע נוסף, תמונות ולתיאום ראיונות:
משרד הדובר - מכון ויצמן למדע
08-9343856 news@weizmann.ac.il