עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
הירשמו לניוזלטר החודשי שלנו:
נגיפים יכולים להיות אורחים די לא מנומסים – הם מרגישים בבית בתא הפונדקאי, משתלטים על הציוד שלו ומשתמשים בו לצרכיהם כדי לייצר נגיפים חדשים. מדעני מכון ויצמן למדע גילו באחרונה כי עזות המצח מרשימה עוד יותר מכפי שחשבו עד כה: הנגיפים מנצלים מנגנון שנועד להגן על התא, כדי לעשות בו כבתוך שלהם ללא התנגדות. הממצאים, שפורסמו בכתב-העת המדעי Nature Immunology, מספקים תובנות חדשות לגבי היחסים המורכבים בין התא המארח לנגיף, ועשויים להוביל למחקרים חדשים על דרכים לטיפול בזיהומים או בתגובות חיסוניות שגויות.
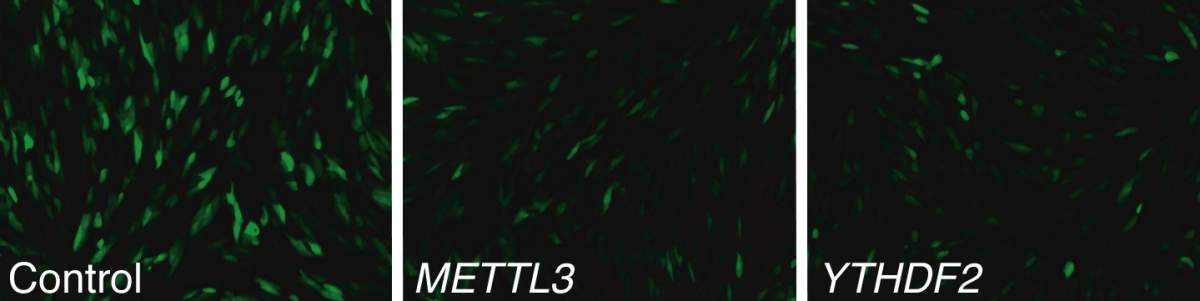
מולקולות אר-אן-אי שליח (mRNA) המכילות את ההוראות הגנטיות לבניית חלבונים, עשויות לעבור, לאחר ייצורן בגרעין התא ולפני הגעתן ליעד, תהליכי שינוי כימיים (מודיפיקציות) המשפיעים על תפקודן. ד"ר נעם שטרן-גינוסר וקבוצת המחקר שלה במחלקה לגנטיקה מולקולרית במכון חקרו את אחד מתהליכי השינוי הנפוצים ביותר – מתילציה של הנוקליאוטיד אדנוזין (m6A). בתהליך זה מעורב אנזים המחבר קבוצת מתיל (המסומנת באות m) לאתר מסוים על-גבי מולקולת האר-אן-אי (6A). מחקרים קודמים דיווחו כי m6A ממלא תפקיד במנגנון ההדבקה הנגיפי. בהתאם לכך, כאשר החדירו החוקרים את נגיף הענק CMV לתאי אדם שגודלו במעבדה וניטרלו את האנזים שאחראי למתילציה, הם גילו כי התפשטות הנגיף נעצרה.

כדי להעמיק את ההיכרות עם מנגנון ההדבקה, יצרו החוקרים, בהובלת תלמיד המחקר רוני וינקלר ובשיתוף פעולה עם ד"ר שרגא שוורץ וקבוצת המחקר שלו, שני סוגי תאים: תאים רגילים ותאים ללא מתילציה של אר-אן-אי. החוקרים הדביקו אותם בנגיף, ומיפו את האתרים על-גבי האר-אן-אי הנגיפי שהיו חשופים ל-m6A. החוקרים ציפו לראות הבדלים באר-אן-אי הנגיפי, אך כאשר השוו מולקולות אלה בתאים המהונדסים למולקולות בתאים הרגילים, הופתעו לגלות כי אין ביניהן הבדל. לעומת זאת, התגלה הבדל משמעותי באר-אן-אי של התאים עצמם: בתאים המהונדסים נמצא ביטוי חזק הרבה יותר של גנים בעלי פעילות אנטי-נגיפית.
הממצאים היו מפתיעים מאוד: מדוע שתאים "תקינים" יכילו מנגנון המאפשר לנגיפים להתרבות ולהפיץ עצמם? בהמשך, גילו החוקרים כי המתילציה התרחשה בעיקר באר-אן-אי של הגן המקודד לחומר האנטי-נגיפי אינטרפרון. אינטרפרון הוא קו ההגנה הראשון של הגוף מפני זיהומים – נשק אנטי-נגיפי רב עוצמה, אך גם רחב-טווח. "בכל תא בגופנו יש חיישנים שיכולים לזהות נגיף ולשחרר אינטרפרון בתגובה", מסבירה ד"ר שטרן-גינוסר. "מנגנון זה הוא חלק ממערכת החיסון המולדת, והוא משפיע גם על התא המותקף וגם על שכניו ועוצר את ההדבקה כמיטב יכולתו, עד שהמערכת החיסונית הנרכשת מצליחה לזהות את הנגיף וללמוד כיצד להילחם בו".
לאחר ניסויים נוספים, הציעו המדענים הסבר אפשרי להצלחה המשופרת של הנגיף דווקא בתאים הרגילים: תהליך המתילציה מפחית את ייצור האינטרפרון. "אינטרפרון, כמו רוב החומרים המיוצרים על-ידי המערכת החיסונית, הוא רעיל. יותר מדי ממנו יכול להרוג את התא", מסבירה ד"ר שטרן-גינוסר. "אז יש פשרה מתמדת בין מלחמה בנגיף לבין הגנה על התא המארח. בגלל שלכמות החומר המיוצרת יש משמעות מכרעת, יש לו מתגי 'כיבוי' ו'הפעלה' מהירים מאוד. אנחנו מעריכים כי m6A פועל כמתג 'כיבוי' – בלעדיו, יוּצר אינטרפרון באופן רציף, והתפשטות הנגיף נעצרה כמעט לחלוטין".
בשיתוף פעולה עם פרופ' יעקוב חנא, יצרו החוקרים עכברים מהונדסים וגילו כי הממצאים בתרביות התאים חזרו על עצמם גם בגוף החי: בחיות המהונדסות עלו רמות האינטרפרון לרמות מסוכנות, אך ההדבקה בנגיף נעצרה.
"אנו סבורים כי חלק גדול מהחוקרים המדווחים על m6A כמודיפיקציה באר-אן-אי הנגיפי לצורך התרבותו, למעשה צפו בנגיפים המנצלים את מנגנון ההגנה בתאי הפונדקאי – מנגנון אשר מותיר לנגיפים השורדים חלון הזדמנות לשכפול", אומרת ד"ר שטרן-גינוסר. "הממצאים שלנו יוצרים תמונה כללית של השלבים המוקדמים של זיהום נגיפי אשר עשויה להוביל לרעיונות חדשים לטיפול או למניעה של מחלות נגיפיות". בנוסף, עשויים הממצאים לספק תובנות לגבי מחלות אוטואימוניות מסוימות, דלקות ומנגנוני ויסות של חומרים כמו אינטרפרון, הדורשים בקרה קפדנית.
מתילציה של אדנוזין (m6A) מתרחשת בכ-25% ממולקולות אר-אן-אי שליח בגוף האדם. #מספרי_מדע |