עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
הירשמו לניוזלטר החודשי שלנו:
התרופה "תוקד" (Tookad), לטיפול בגידולים ממאירים מוצקים שפיתחו מדעני מכון ויצמן למדע, מאושרת כיום לטיפול בחולי סרטן הערמונית בשלבים מוקדמים באירופה, במקסיקו ובישראל ומצויה תחת בחינה של רשות המזון והתרופות האמריקאית (FDA). מחקרים קודמים הראו כי התרופה מטפלת בסרטן באמצעות השבתה מהירה של אספקת הדם לגידול: היא הופכת את מערכת כלי הדם של הגידול ל"חממת מוות" זמנית המובילה להשמדת תאי הגידול. עם זאת, עד כה לא הייתה דרך אמינה לבחון כיצד בדיוק פועלת התרופה. במחקר חדש יישמו מדענים בארצות-הברית, בשיתוף פעולה עם מעבדתו של פרופ' אביגדור שרץ במכון, שיטת דימות חדשנית במטרה לעקוב בזמן אמת ובדיוק רב אחר השינויים במערכת כלי הדם של הגידול – שינויים המובילים למיגורו באופן בררני וללא פגיעה ברקמות הסמוכות.
מקורה של תוקד, פרי פיתוחם של פרופ' שרץ מהמחלקה למדעי הצמח והסביבה, ופרופ' יורם סלומון המנוח מהמחלקה לבקרה ביולוגית – בכלורופיל הנמצא בחיידקים ימיים המבצעים פוטוסינתזה. התרופה, הניתנת בעירוי לווריד ומתפנה במהירות ממחזור הדם, נכנסת בגוף לפעולה רק לאחר חשיפה לאור הנעשית באמצעות סיבים אופטיים דקים המוחדרים לרקמה הפגועה. בעקבות החשיפה לאור, התרופה מגיבה עם מולקולות החמצן שבכלי הדם והופכת אותן לרדיקלים של חמצן וחנקן חמצני. נוכחות הרדיקלים מעוררת שרשרת תהליכים המובילה לחסימת כלי הדם של הגידול ולהרס תאיו. עם זאת, עד לאחרונה לא הייתה דרך יעילה לנטר מה בדיוק קורה בגוף לאחר החשיפה לאור, שכן הטכנולוגיות הזמינות לא אפשרו דימות ברזולוציה גבוהה מספיק.
"השיטה החדשה אפשרה לנו לקבל תמונות יוצאות מן הכלל, החושפות את תגובת הרקמות ואת השינויים המיקרוסקופיים בכלי הדם לאחר הטיפול"

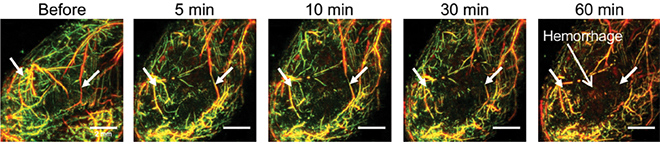
ד"ר יאן גרים ממרכז הסרטן ממוריאל סלואן קטרינג שבניו-יורק – שבו נבחנת כעת תוקד בניסויים קליניים – החליט לחקור את מנגנון הפעולה של התרופה באמצעות שיטת דימות חדשה: מֵזוֹסְקוֹפְּיָת סריקה אופטו-אקוסטית (RSOM). בשיטה זו חושפים את הרקמה להבזקי לייזר הגורמים למולקולות סופגות אור להתרחב – במקרה זה, המוגלובין; בהמשך, עוקבים אחר גלי העל-שמע (אולטרה-סאונד) הנוצרים בשל התרחבות זו. יישום השיטה אִפשר לחוקרים לקבל תמונה ברזולוציה גבוהה של כלי הדם בתוך הגידול ובסביבתו לפני, תוך כדי ואחרי הטיפול בתוקד במודל של סרטן בעכברים. הרעיון לרתום את השיטה לחקר התוקד עלה במוחו של ד"ר גרים לאחר ששוחח בנושא עם פרופ' ואסיליס נצ'אקריסטוס מהאוניברסיטה הטכנית של מינכן, שהגיע לשבתון במעבדתו. בעקבות כך, הוא איגד כוחות עם פרופ' נצ'אקריסטוס ועם מעבדתו של פרופ' שרץ.
"RSOM אפשרה לנו לקבל תמונות יוצאות מן הכלל, החושפות את תגובת הרקמות ואת השינויים המיקרוסקופיים בכלי הדם לאחר הטיפול", כתב ד"ר גרים בבלוג באתר של כתב-העת המדעי Nature. התמונות הראו כי זמן קצר לאחר שהעכברים טופלו בתוקד, נחסמו כלי הדם הגדולים המזינים את הגידולים שלהם, וכלי הדם הקטנים שבתוך הגידולים החלו להיהרס בהדרגה. שטף הדם שנוצר במקום החדיר למיקרו-סביבה של הגידול רדיקלים של חמצן וחנקן חמצני שגרמו הרס נוסף – כפי שקורה בדרך כלל כשאיזור שנמנע ממנו חמצן מוצף בדם – כך שלבסוף כל מערכת כלי הדם של הגידול קרסה, והרקמה הסרטנית נהרסה. גידולים בעלי כלי דם מרובים הושפעו מהתרופה יותר מאשר גידולים בעלי כלי דם מעטים. מחקר נוסף עשוי לאפשר להעצים את השפעת תוקד גם בגידולים בעלי כלי דם מעטים.
חשיפת מנגנון הפעולה של תוקד ברמת פירוט חסרת תקדים זו עשויה לייעל את הטיפול בתרופה. כך למשל, ניטור מערכת כלי הדם של הגידול בחולים עשוי לאפשר לחזות עד כמה הטיפול עתיד להיות יעיל. ניטור זה עשוי לאפשר גם להתאים את הטיפול בחולים במטרה להבטיח שהגידול ימוגר בהצלחה או לחלופין להימנע מטיפול-יתר העלול לפגוע ברקמות הבריאות הסמוכות.
במחקר השתתפו ד"ר קטיה הדיקה, שעברה תחילה הכשרה במעבדתו של פרופ' שרץ, ד"ר מגדלנה סקובל, ד"ר שריל רוברטס, קמילה לונגו-מאצ'אדו, קראן נגר, שיאו-טינג הסו, ד"ר קוואנגה קים, ד"ר תומס ריינר וד"ר ג'ונתן קולמן ממרכז הסרטן ממוריאל סלואן קטרינג; ד"ר לילך עגמי מהמחלקה למדעי הצמח והסביבה של מכון ויצמן למדע; ופרופ' מורד אומר ופרופ' אנדריי ברז'נוי מהאוניברסיטה הטכנית של מינכן.