עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
הירשמו לניוזלטר החודשי שלנו:
ככל שהסרטן אלים יותר, כך הטיפול בו מאתגר יותר. הבנה של המנגנונים המולקולריים שהופכים גידולים לאגרסיביים במיוחד תפתח את הדלת בפני פיתוח תרופות חדשות לסוגי סרטן המתפשטים במהירות. במחקר חדש, חושפים מדעני מכון ויצמן למדע, בשיתוף עם המכון הלאומי לסרטן בארצות-הברית ועם מוסדות מחקר נוספים, מנגנון האחראי להתפשטות סרטן שד אלים במיוחד.
המחקר יצא לדרך עם ניתוח חישובי מקיף של נתונים מכמה מאגרי מידע ובהם נתונים על תוחלת החיים של חולות בסוגים שונים של סרטן השד ועל גנים פעילים במיוחד בגידולים אלימים. כך הצליחו החוקרים להרכיב מתוך רשימה של כ-25 אלף גנים נבחרת מצומצמת של 20 גנים המעורבים ביכולת של גידולי שד אלימים ליצור גרורות. שניים מהגנים שבראש הרשימה מעורבים בחלוקת תאים וכבר משמשים מטרה לתרופות לסרטן. הגן השלישי, לעומת זאת, הפתיע את החוקרים: זהו גן המקודד את החלבון NUP93 – אחד מבין שלל מרכיביהן של התעלות בקרום העוטף את גרעין התא.
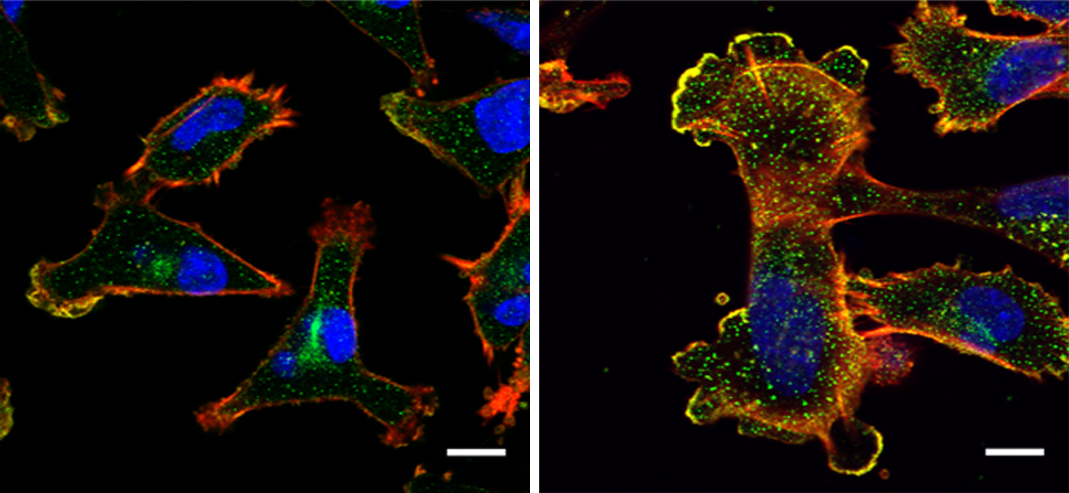
החוקרים הבחינו שבחולות סרטן שד עם תוחלת החיים הנמוכה ביותר, חלבון זה נמצא בכמויות גדולות במיוחד. יותר מכך, ככל שמחלתן התקדמה, נוספו להן עוד עותקים של הגן המקודד את NUP93, כך שהגנום שלהן כלל שניים או אפילו שלושה עותקים של גן זה במקום עותק בודד. באופן מעניין, הגידולים של רבות מחולות אלה לא היו רגישים להורמון אסטרוגן. ידוע כי גידולים מסוג זה, המהווים כשליש מכלל מקרי סרטן השד, עמידים במיוחד לטיפולים, שכן הקולטנים לאסטרוגן משמשים מטרה לתרופות הורמונליות לסרטן. "חשוב במיוחד להבין סוגים אלה של סרטן שכן האמצעים לטפל בהם עדיין מוגבלים ביותר", אומר ראש קבוצת המחקר פרופ' יוסי ירדן מהמחלקה לבקרה ביולוגית.

בעקבות הממצאים התחקו המדענים במעבדה אחר תהליכים סרטניים בגוף האדם בעזרת תאי רקמת שד בתרבית, והצליחו לאשש קשר בין מידת האלימות של הגידול ובין כמויות גדולות של NUP93 בתאים. כך למשל, כאשר החוקרים חסמו באמצעות הנדסה גנטית את היכולת של תאי רקמת השד לייצר NUP93, התאים נותרו במקומם, כלומר לא הפכו לגרורתיים. מנגד, כאשר החוקרים הנדסו תאי רקמת שד כך שייצרו רמות גבוהות של החלבון NUP93, כושר התנועה של התאים גדל עוד יותר, בדומה לתאי סרטן המתפשטים לאיברים רחוקים ויוצרים גרורות. בסדרת ניסויים נוספת בעכברים, תאים המכילים כמויות גדולות של NUP93 התפשטו לריאות, בעוד תאים ללא החלבון נותרו במקומם.
התפשטות גרורות היא סיבת המוות העיקרית בסרטן השד. לפיכך שיבוש יכולת הנדידה של תאי הסרטן הינו כיוון מבטיח לפיתוח תרופות עתידיות
בשלב הבא של המחקר פענחו המדענים את המנגנון שמאפשר לסרטן לנצל את NUP93 למטרותיו: התעלות שחלבון זה מייצר בקרום הגרעין, משמשות חלבוני הובלה הקרויים אימפורטינים, אשר משנעים, בין היתר, פקודות גדילה ונדידה מנוזל התא לדי-אן-אי שבגרעין. כך למעשה מקבל הסרטן גישה לגנום התא ומגייס אותו לצרכיו, קרי הגברת יכולת הנדידה של התא במטרה ליצור גרורות ולהתפשט בגוף.
"כדי להעביר לגנום את אותות הגדילה המגיעים מבחוץ, הסרטן זקוק לאוטוסטרדה לגרעין", מסביר פרופ' ירדן. "ככל שיש בדרך יותר תעלות NUP93 זמינות, כך האות עובר מהר יותר והסרטן מתפשט מהר יותר".
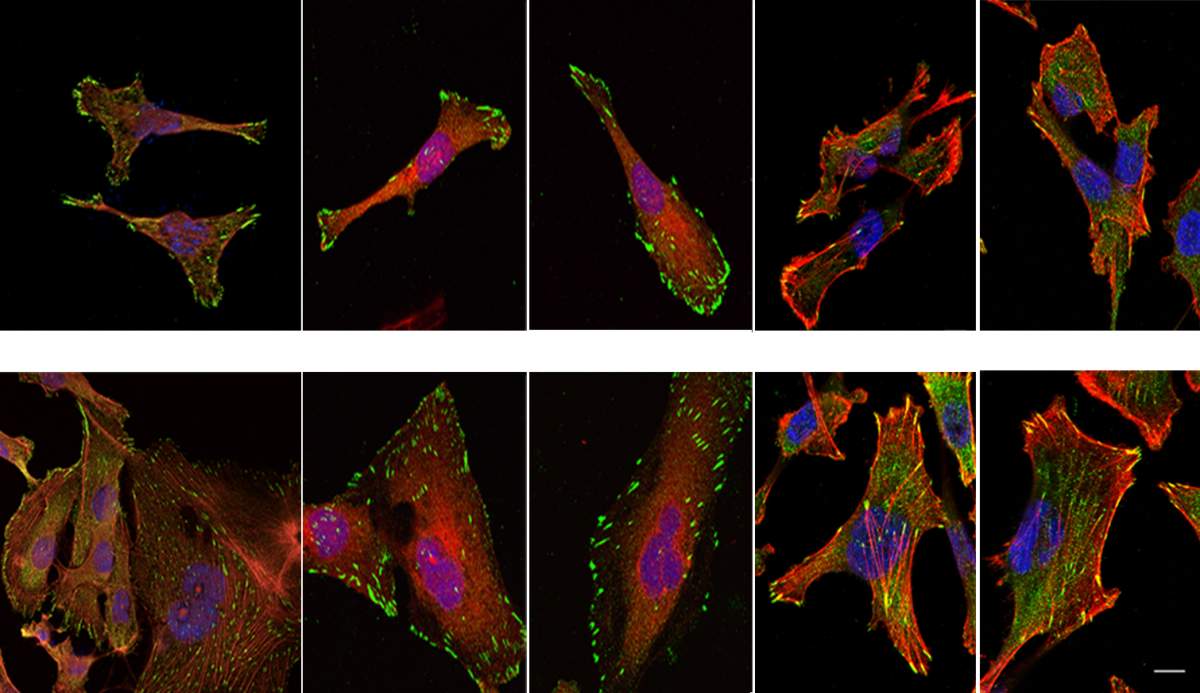
מכיוון שהתפשטות הסרטן, כלומר יצירת גרורות, היא סיבת המוות העיקרית בסרטן השד, שיבוש יכולת הנדידה של תאי הסרטן הינו כיוון מבטיח לפיתוח תרופות עתידיות. עם זאת, לא מומלץ לחסום את תעלות ה-NUP93 לגמרי, שכן בתאים בריאים תעלות אלה ממלאות שלל תפקידים חיוניים, למשל העברת אותות הנחוצים לריפוי פצעים.
בניסוי שערכו בעכברים נקטו מדעני המכון גישה ממוקדת יותר: למנוע מחלבוני ההובלה, האימפורטינים, להעמיס עליהם את המטען הקטלני – הפקודות המגבירות את כושר התנועה של התאים. הם עשו זאת באמצעות פפטידים קטנים החוסמים באופן בררני את האימפורטינים הרלוונטיים וכך הפחיתו באופן משמעותי את יכולתם של התאים לנדוד ולגרום גרורות. ממצאים אלה מהווים נקודת מוצא לפיתוח תרופה לטיפול בגידולי שד אלימים – גם בשלבים מתקדמים של המחלה.
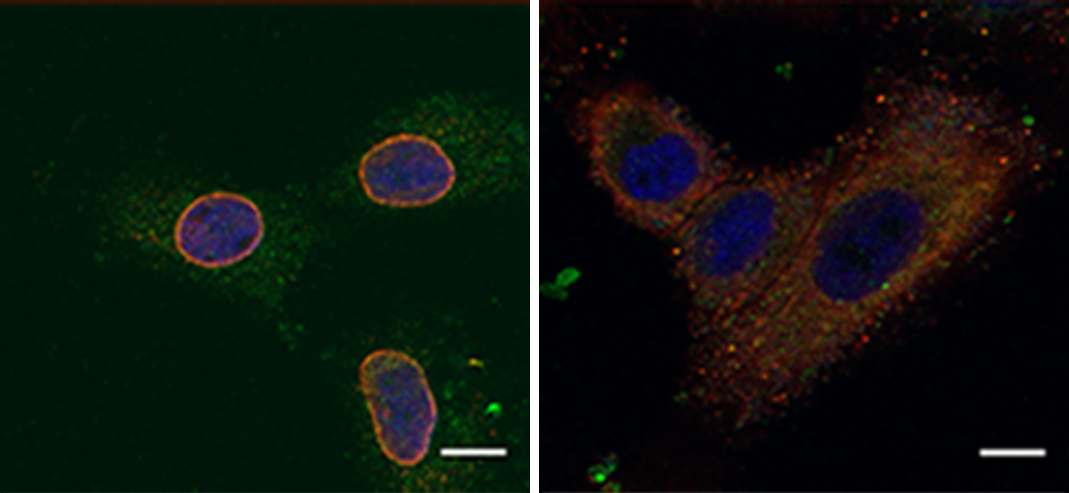
במחקר השתתפו פרופ' איתן רופין וד"ר ג'ו סאנג לי מהמכון הלאומי לסרטן, ארה"ב; ד"ר נישנת נתרג', ד"ר אשיש נורונחה, ד"ר סומה גוש, ארונצ'לאם סקר, ד"ר בנימין צוקרמן, ד"ר מושית לינדזן, ד"ר אמיליו טרסיטנו, ד"ר סוואטי סריבסטבה, דיאנה דרגו-גרסיה, פרופ' איגור אוליצקי ופרופ' רוני זגר מהמחלקה לבקרה ביולוגית; ד"ר הרשה ראג' מוהאן ראג'ו, פרופ' סימה לב ופרופ' תמר גיגר מהמחלקה לביולוגיה מולקולרית של התא; ד"ר מיכאל סליטרניק מאוניברסיטת תל-אביב; ד"ר עידו ליבנה ופרופ' אהרון צ'חנובר מהטכניון; וד"ר אוסקר רואדה ופרופ' קרלוס קלדס מאוניברסיטת קיימברידג'.
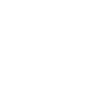
החלבון NUP93 הינו חלק מצבר גדול המכיל כ-1,000 חלבונים מ-40 סוגים שונים.