עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
הירשמו לניוזלטר החודשי שלנו:
אדם נואש עלול לבחור בדרכים נואשות, והדבר נכון לא רק לבני-אדם. לפני חמישה עשורים, התגלה כי חיידקים המצויים תחת איום קיומי, מפעילים תוכנית חירום גנטית, מסוכנת אך יעילה, הקרויה "תגובת SOS". באחרונה גילו מדעני מכון ויצמן למדע כי גם תאים סרטניים נואשים מפעילים תגובת SOS המסייעת להם לפתח עמידות לתרופות נוגדות סרטן. החוקרים פיתחו שיטה לחסימת מנגנון ה-SOS בעכברים, אשר עשויה להוביל לפיתוח טיפול חדש בבני-אדם.
צוות המחקר בראשות פרופ' יוסף ירדן מהמחלקה לאימונולוגיה ורגנרציה ביולוגית של המכון חקר תת-סוג של סרטן ריאות, המאפיין דווקא חולים שאינם מעשנים. ישנה תעלומה סביב סרטן זה, לא רק מפני שהוא אינו קשור לעישון, אלא גם מפני ששכיחותו שונה מאוד בחלקים שונים של העולם. כך למשל, בארץ ובארצות-הברית הוא מהווה כ-12% מכלל מקרי סרטן הריאות, בעוד בארצות מזרח אסיה שכיחותו בקרב חולי סרטן הריאות היא יותר מ-35%.

ישנן כיום כמה תרופות יעילות לטיפול בגידולי ריאות אלה, המאופיינים במוטציות בגן הקרוי EGFR. ואולם לאחר כשנה הגידולים מפתחים עמידות, והתרופות מפסיקות לפעול. בשלב זה יקבלו החולים תרופות דור שני ודור שלישי, אך בסופו של דבר הגידול יפתח עמידות לכל אחת מהן.
"רצינו להבין כיצד מתפתחת העמידות כדי ללמוד כיצד ניתן למנוע אותה", מסביר פרופ' ירדן, ששאב השראה למחקר ממקור מפתיע – חיידקים. בשנת 1975 גילה הביולוג הקרואטי מירוסלב רדמן כי חשיפה לכימיקלים רעילים, לאנטיביוטיקה או לקרינה אולטרה-סגולה מובילה חיידקים ליצור מוטציות רבות לאורך הדי-אן-אי שלהם. "כאשר תגובת ה-SOS נתגלתה לראשונה, המדענים התקשו להאמין שהיא אמיתית. האם החיידקים באמת מייצרים בכוונה כל-כך הרבה מוטציות? הרי המוטציות עצמן מסכנות אותם", אומר פרופ' ירדן. "אך תגובת ה-SOS מופעלת אך ורק כאשר החיידקים עומדים בפני הכחדה, ואז משתלם להם לקחת את הסיכון כדי שלפחות לחלקם תהיה עמידות לאיום הקיומי".
כיוון מחקר זה הוכיח את עצמו: פרופ' ירדן ועמיתיו גילו כי תחת מתקפה של תרופות נוגדות סרטן, מתפתחת עמידות בגידולי ריאות אלה באמצעות מנגנון הדומה לתגובת ה-SOS בחיידקים. הממצאים התקבלו בעזרת ניסויים הן ברקמות גידול בתרבית והן בעכברים, בהובלת ד"ר אשיש נורונחה, אז תלמיד מחקר במעבדתו של פרופ' ירדן, ובשיתוף פעולה עם צוות גדול של מדענים ורופאים מישראל, אירופה וארצות-הברית.
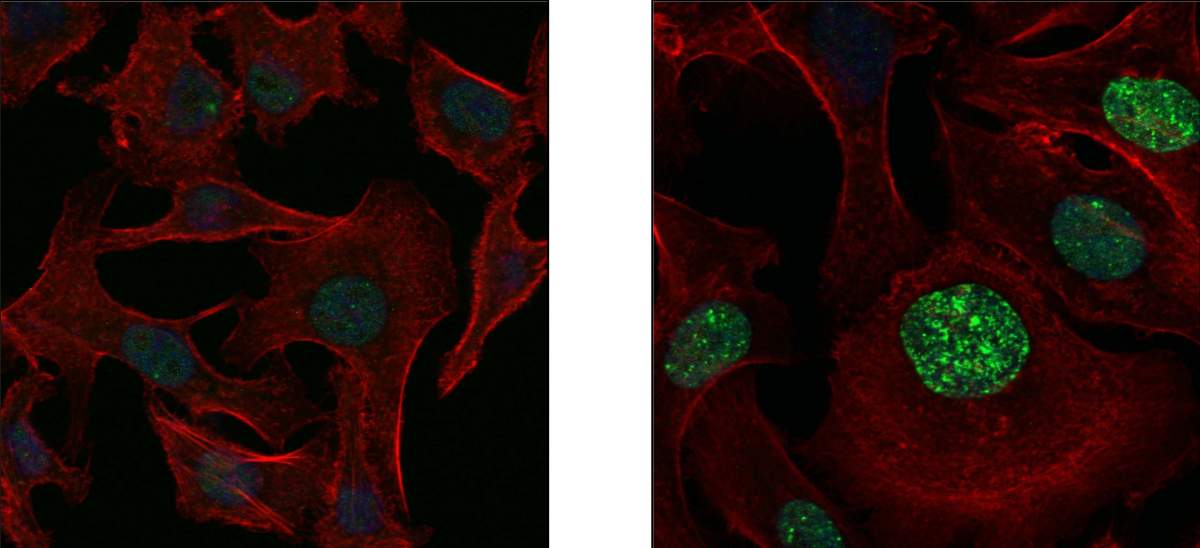
החוקרים גילו כיצד פועלת גרסת ה-SOS של הסרטן על כל פרטיה המולקולריים. כאשר מושמדים תאי סרטן רבים, השאריות שהם מותירים אחריהם מפעילות בתאי הגידול הנותרים מנגנון המוביל להחלפת האנזימים האחראים על העתקת הדי-אן-אי בגרעיני התאים. במקום אנזימים קפדנים המבצעים את ההעתקה בדיוק רב, כולל תיקון טעויות, מופעלים אנזימים רשלנים במתכוון, המייצרים מוטציות רבות בכל פעם שהתא מתחלק. נוסף על האנזימים הרשלנים, מופעל גם מנגנון המשבש את אספקתן התקינה של אבני הבניין הנחוצות להעתקת הדי-אן-אי: הנוקלאוטידים A, T, G ו-C. מנגנון זה מייצר עודף של זוג נוקלאוטידים אחד, G + A, בהשוואה לשניים האחרים, וכך נוצרות טעויות נוספות בתהליך ההעתקה.
""כאשר תגובת ה-SOS נתגלתה לראשונה, המדענים התקשו להאמין שהיא אמיתית. האם החיידקים באמת מייצרים בכוונה כל-כך הרבה מוטציות? הרי המוטציות עצמן מסכנות אותם"
וחשוב מכל, המדענים הצליחו לזהות את המפעיל המרכזי של תגובת ה-SOS בגידול: קולטן תאי הקרוי AXL. קולטן זה המתבטא על-פני קרום התא פועל הן כחיישן הקולט אותות מתאי הסרטן המתים והן כמתג הראשי להפעלת המנגנונים ליצירת המוטציות. פעולתו מהירה ופגיעתו רעה: בתוך שנה מתחילת הטיפול התרופתי, כל התאים בגידול עלולים להכיל מוטציות המעניקות להם עמידות.
בעקבות ממצאים אלה, יצאו המדענים לחפש דרכים לבלום את תגובת ה-SOS של הסרטן. הם מצאו כי כאשר הם מעלימים את קולטן ה-AXL בתאי הגידול, הם יכולים למנוע את הופעת העמידות לתרופות. "זה היה רגע של 'אאוריקה!' – הבנו שצריך לחפש טיפול שמנטרל את הקולטן הזה", אומר פרופ' ירדן.

אך המשימה הייתה קשה מכפי שניתן היה לצפות. החוקרים הצליחו ליצור נוגדן החוסם את ה-AXL בעכברים, אך הוא לא היה מספיק יעיל, לא כאשר ניתן לבדו ולא בשילוב עם התרופה טגריסו המשמשת לטיפול בסרטן ריאות המאופיין על-ידי מוטציות בגן EGFR. רק כאשר השתמשו החוקרים בטיפול משולש – הנוגדן, טגריסו ותרופה נוגדת סרטן נוספת – ארביטוקס שפותחה על בסיס מחקריהם של פרופ' ירדן ופרופ' מיכאל סלע המנוח – רק אז נחסמה האפשרות לפתח עמידות לתרופות והגידולים נעלמו לבלי שוב.
ממצאי המחקר עשויים לסלול את הדרך לטיפול מבטיח בסרטן ריאות בחולים לא-מעשנים, ואולי גם בסוגי סרטן נוספים שבהם מתפתחת עמידות לתרופות הקיימות. עם זאת, יידרשו כמה שנים לפיתוח הנוגדנים לקולטן ה-AXL בבני-אדם ולעריכת ניסויים קליניים של הטיפול המשולש.
במחקר השתתפו גם ד"ר נישנת נתרג', ד"ר מושית לינדזן, ד"ר סומה גוש, ד"ר ארתורו סימוני ניאבס, אאקנשקה ורמה, רישיתה צ'טרג'י, ארונצ'לאם סקר, ד"ר סוונדו גירי ודיאנה דרגו-גרסיה מהמחלקה לאימונולוגיה ורגנרציה ביולוגית של מכון ויצמן למדע; ד"ר וולס רובינסון, ד"ר סאנג'ו סינחה ופרופ' איתן רופין מהמכון הלאומי לסרטן, ארה"ב; ד"ר בני ז'יטומירסקי, ד"ר יערה אורן, ד"ר בריאן דאניש, גידאופור אזיק ופרופ' גד גץ ממכון ברוד של MIT ואוניברסיטת הרווארד; ד"ר שרה אוסטר ופרופ' ראמי עקילאן מהאוניברסיטה העברית בירושלים; ד"ר ספטפרנה מוקהרג'י ופרופ' משה אורן מהמחלקה לביולוגיה מולקולרית של התא של המכון; ד"ר ריינר וויל, ד"ר סימון בורגוני ופרופ' סטפאן ווימן מהמרכז הגרמני לחקר הסרטן (DKFZ); ד"ר אלכסנדר ברנדיס מהמחלקה לתשתיות מחקר מדעי החיים של המכון; לוקאס קר, ד"ר וויי וואו, ד"ר קולין בלייקלי וד"ר טרבר ביוונה מאוניברסיטת קליפורניה, סן-פרנסיסקו; ד"ר יונגמין צ'ונג וד"ר ג'ו סאנג לי מאיניברסיטת סנגקיונקואן שבקוריאה; פרופ' מטיה לאוריאולה, פרופ' מיקלאנג'לו פיורנטינו ופרופ' אנדראה ארדיצוני מאוניברסיטת בולוניה שבאיטליה; ד"ר לחשמי פארידה ממכון המחקר של IBM שבמדינת ניו-יורק, ארה"ב; פרופ' ג'ואן ברוגי מבית הספר לרפואה של הרווארד; ופרופ' אביב רגב מחברת ג'ננטק, ארה"ב.
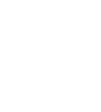
סרטן הריאות הוא סיבת המוות מספר 1 מסרטן. אחד מכל 15 גברים ואחת מכל 17 נשים יפתחו סרטן ריאות במהלך חייהם. רובם יהיו מעשנים, אך עד 20% מהמקרים, בממוצע, יופיעו באנשים שלא עישנו מעולם או עישנו בימי חייהם פחות מ-100 סיגריות.