בשבוע שעבר הופיעו בכתב-העת "רשומות האקדמיה האמריקאית למדעים" (PNAS), לא פחות מחמישה מאמרים שלכתיבתם היו שותפים מדעני מכון ויצמן למדע. להלן עיקרי המחקרים החדשים בתמצות מרבי (ובסדר אקראי):
1.
פרופ'
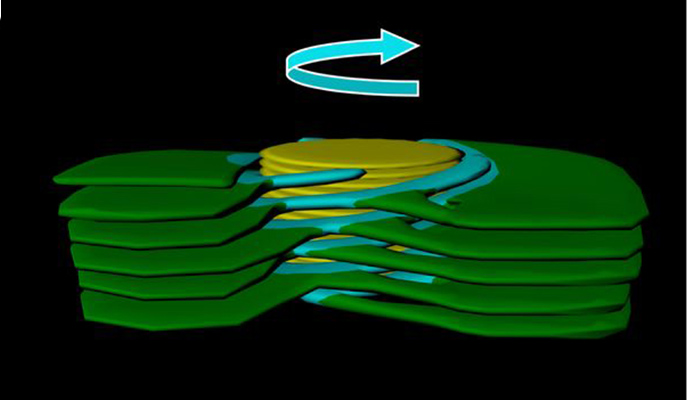
קובי לוי מהמחלקה לביולוגיה מבנית חקר ביחד עם מדענים מאיטליה, בריטניה וספרד כ
יצד נפרמים גדילי הדי-אן-אי לצורך שכפול, תיקון או שעתוק. החוקרים שילבו בין פיסיקה, כימיה וביולוגיה – ובין הדמיות מחשב וניסויים במעבדה – וגילו כי דינמיקה אסימטרית של זיווג בין בסיסים מניעה את ההפרדה המדורגת של צמדי חומצות הגרעין. הממצאים מצביעים על אפשרות קיומה של שכבת רגולציה גנטית שבאה לידי ביטוי במידת ה"פרימות" של הסליל הכפול.
2.
קבוצות המחקר של ד"ר
אפי אפרתי מהמחלקה לפיסיקה של מערכות מורכבות ופרופ'
זיו רייך מהמחלקה למדעים ביומולקולריים
פענחו את המבנה הסבוך של רשת הממברנות הפנימיות בכלורופלסטים – אברוני הצמח שבהם מתבצע תהליך הפוטוסינתזה. באמצעות שימוש בדימות טומוגרפיית אלקטרונים, גילו המדענים כי הרשת מיוצבת על-ידי מערכים של מבנים דמויי סליל בעלי כיווניות שמאלית או ימנית. מערכים דומים מצויים ככל הנראה הן באברון התאי המכונה רשתית תוך-פלזמית והן בחומר גרעיני דחוס במיוחד בכוכבי נויטרונים. החוקרים משערים כי מערכים אלה מייצגים אמצעי אוניברסלי לחיבור בין שכבות או יריעות צפופות.
3.
פרופ'
שמואל פיטרוקובסקי מהמחלקה לגנטיקה מולקולרית
זיהה סוג חדש של אינטרונים חלבוניים (אינטאינים), והראה, בשיתוף פעולה עם קבוצת מחקר בגרמניה, כי אינטאינים אלה יכולים לחבר חלבונים אחרים בתנאים שעד כה היו בלתי-אפשריים. בין היתר אינטאינים חדשים אלה מאפשרים הכנסת שינויים בנוגדנים ובחלבונים בעלי מבנה דומה מבלי לשבש את המבנה המקורי שלהם. לממצאים צפויים להיות שימושים רבים בביולוגיה של התא, בביוכימיה ובביוטכנולוגיה.
4.
במחקר שהובילה קבוצת המחקר של פרופ'
עדה יונת מהמחלקה לביולוגיה מבנית, בשיתוף חוקרים מדנמרק ומאוסטרליה, התגלה
יעד אפשרי חדש לטיפול אנטיביוטי המתמקד בבתי החרושת לחלבונים של החיידקP. aeruginosa . החוקרים השוו באמצעות מיקרוסקופיה קריו-אלקטרונית בין מבנים ריבוזומליים בזנים של החיידק שפיתחו עמידות לאנטיביוטיקה, ובזנים שאינם עמידים, וזיהו נקודת תורפה שאפשר לחולל בה שינויים, במטרה לשבש את ייצור החלבונים בחיידק. בנוסף הסבירו החוקרים מנגנון עמידות בחיידק זה לטיפולים אנטיביוטיים ממשפחת האמינוגליקוזידים, שלא היה ידוע עד כה.
5.
