אחד מכל שני מחקרים שמבוצעים במכון ויצמן למדע, בתחומי מדעי החיים, מכוונים בדרך זו או אחרת להדברת מחלות הסרטן. בשלב הראשון של מסע המלחמה הארוך הזה שואפים המדענים להבין את המנגנונים האחראיים להפיכתו של תא בריא לתא סרטני. הבנת התהליכים האלה עשויה לסלול את הדרך לפיתוח שיטות לבלימת התפתחותן של המחלות הסרטניות. היום כבר ברור שפגמים גנטיים ממלאים תפקיד מרכזי במנגנונים האחראיים לשינויים התאיים המובילים להתפתחות מחלה סרטנית. לפיכך, המתקפה הרב תחומית של מדעני המכון על הסרטן מתחילה במאמץ להבנת התפקיד הראשוני שממלאים גנים מסויימים בתהליכי ההתמיינות ובקרת ההתרבות של תאים, ובאפיון השיבושים החלים בהתבטאותם של גנים סרטניים. המתקפה המשולבת נמשכת ועוקבת אחר המחלה בכל שלביה: התקשורת הביןתאית ובמיוחד התפקיד שממלאים בה גורמי גידול וגורמים מעכבי גידול המווסתים ומבקרים את התרבות התאים, והמנגנונים האחראיים ל"התאבדותם" של תאים. מחקרים אחרים נועדו לפתח שיטות לבלימת התפשטותן של גרורות סרטניות, בהתבסס על הבנת תפקידה של המערכת החיסונית בהגנת הגוף מפני תאים סרטניים. גנטיקאים ביולוגים של התא אימונולוגים וביופיסיקאים משתפים פעולה במאמץ ביןתחומי זה. הם מפעילים בין היתר מגוון שיטות של גנטיקה מולקולרית אימונולוגיה (תורת החיסון) ומיקרוסקופיה, לצד טכנולוגיות מחקר מתקדמות כגון ספקטרוסקופיה של תהודה מגנטית גרעינית (במגמה לאתר סרטן שד ולסייע בריפויו). הישגיהם של מדעני המכון בהבנת התהליכים הגנטיים הבסיסיים האחראיים להתפתחות סרטן, הובילו להישגים גם במחקרים הקרובים יותר אל אופק היישום הרפואי. בין אלה אפשר למנות את זיהויו של גן אחד ויחיד שפגמים בו מובילים להתפתחות מחלות סרטן רבות, זיהוי גנים אחרים הממלאים תפקיד מרכזי בהתפתחות לוקמיה מטיפוסים מסוימים, פיתוח תרכיב חיסון נגד סרטן ריאה, פיתוח טכניקות להשתלת מוח עצם (טיפול הנחוץ לחולי לוקמיה), ופיתוח טכניקות פוטודינמיות שמיועדות לאפשר תקיפה של גידולי סרטן עור מסוג מלנומה.
שלבי התפתחותו של הסרטן
מדעני המכון היו בין הראשונים - עוד בשנות החמישים - שהראו כי גידולים סרטניים מסוגים מסוימים מתפתחים בתהליך דו-שלבי וכי התפתחות הסרטן תלויה בנוכחותם של גורמים אחדים (עד לאותו זמן סברו שדי בנוכחותו של גורם אחד ויחיד כדי להביא להתפתחות מחלה סרטנית). תגלית זו סייעה בהבנת ה"תסריטים" השונים העלולים להוביל להתפתחותה של מחלה סרטנית, ובנוסף לכך סיפקה הסבר לפער הזמן (המגיע לעתים לעשרות שנים) בין החשיפה לחומרים מסרטנים, לבין התפתחות מחלה סרטנית.
תאים סרטניים חוזרים למוטב
מדעני המכון היו הראשונים שהראו (בשנות החמישים והשישים) כי אפשר לגרום לתאים סרטניים - בתרביות רקמה ובגוף החי - לשוב ולנהוג כתאים רגילים ובריאים. ממצא זה הוביל לפיתוח גישה חדשנית לטיפול בסרטן באמצעות שיקום יכולתם של התאים לגדול ולהתפתח באופן שפיר ומסודר.
לאבחן את הסרטן
מדעני המכון פיתחו סוללה של נוגדנים מונוקלונליים (חד-שבטיים) הנקשרים באופן ייחודי למרכיבים מוגדרים של השלד התאי (רשת סיבי הביניים). באמצעות הגדרתם המדויקת של סיבי הביניים האלה אפשר לקבוע את המהות ואת המקור של גידולים ממאירים שדרגת ההתמיינות שלהם נמוכה, ולכן קשה להגדירם בשיטות המיקרוסקופיות הרגילות. גישה זו מאפשרת לפתולוגים לפענח ממצאי ביופסיות, דבר שמסייע לרופאים לברור בשביל חוליהם את התכשירים האנטי-סרטניים המתאימים ביותר.
המדענים הראו כי שניים מתוך שלושה סוגי הסיבים הבונים את השלד התאי מכילים אבני בניין זהות בכל סוגי התאים, בעוד שמערכת סיבים שלישית, המכונה רשת "סיבי הביניים", בנויה מחלבונים השונים - בצורה אופיינית - מרקמה לרקמה. מתברר כי שינויים ממאירים כשלעצמם אינם גורמים לתמורות משמעותיות בהרכבם של סיבי הביניים בתאי הרקמה הנפגעת. לפיכך, איפיונם של סיבים אלה בתאי הגידול עשוי ללמד על רקמת המוצא אשר ממנה נגזר הגידול.
הנוגדנים המיוחדים שפיתחו מדעני המכון נקשרים באופן ייחודי למרכיבים הפפטידיים הייחודיים לסיבים של סוגי תאים שונים, ובכך הם מאפשרים את זיהויים.
גנים מדכאי סרטן
היום כבר ברור שפגמים גנטיים ממלאים תפקיד מרכזי במנגנונים האחראים לשינויים התאיים המובילים להתפתחות מחלה סרטנית. לפיכך, המתקפה הרב-תחומית של מדעני המכון על הסרטן מתחילה במאמץ להבנת התפקיד הראשוני שממלאים גנים מסוימים בתהליכי ההתמיינות ובקרת ההתרבות של תאים, ובאפיון השיבושים הגנטיים המובילים להתפתחות הסרטן.
הגנים המעורבים בהתפתחות מחלות סרטניות נחלקים לשתי קבוצות עיקריות: גנים שפעילותם והתבטאותם גורמות להתפתחות סרטן, וגנים שהתבטאותם ופעילותם התקינה מדכאת את התהליכים שעלולים להביא להתפתחות סרטן. כאשר חל "קילקול" בגן מדכא סרטן, הוא לא מצליח למלא את ייעודו, דבר שעלול לאפשר את התפתחותה של מחלה סרטנית.
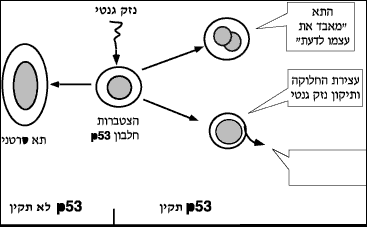
מדעני המכון שיבטו לראשונה את הגן מדכא הסרטן p53, שפגמים בו מעורבים בתהליכי התפתחותם של כמחצית מכלל הגידולים הסרטניים בבני אדם. מדעני המכון מילאו תפקיד מרכזי בהבנת תפקידו של הגן הזה כגן מדכא סרטן. בהמשך התברר שהחלבון, שהוא התוצר של הגן הזה, "מזהה" נזקים שמתחוללים במטען הגנטי כולו (כתוצאה מנזקי קרינה, או נזקים סביבתיים אחרים, וכן כתוצאה משגיאות הנוצרות בעת הכפלת המטען הגנטי בתהליך התרבות התאים). החלבון תוצר ה - p53 יכול לאמוד את הנזק ואז "להחליט" אם לתקנו ולאפשר בכך את המשך חייו של התא, או - במקרה שהנזק גדול מדי - לגרום להשמדת התא.
מדעני המכון הראו לראשונה שה- p53 קשור בסיום תהליך התמיינות התאים ובהשראת "מוות מתוכנת" של תאים, המכונה "אפופטוסיס". מתברר שבכל אחד מתאי הגוף טמונה מעין "תוכנת התאבדות גנטית" ייחודית, שכשמפעילים אותה, היא גורמת לתאים לאבד את עצמם לדעת. תופעה זו של השמדה עצמית קרויה אפופטוסיס (ביוונית "השלה", או "השרה", כינוי שנובע מהדמיון שבין התופעה לבין תהליך השלכת שבו מתים עלי העצים בסתיו). היכולת להורות לתאים למות, חיונית ביותר לפעילותו התקינה של התאים בגוף. איבוד היכולת הזאת - לדוגמה, כתוצאה ממוטציה בגן מדכא הסרטן p53 - עלולה להוביל להתרבות תאים בעלי מטען גנטי פגום, שמשמעותה עלולה להיות התפתחות גידול סרטני. תופעה דומה עלולה להתחולל כאשר, כתוצאה מפגם בתפקודו של הגן p53, ממשיך תהליך התמיינותם של התאים ואינו מסתיים כראוי.
מדעני המכון ממשיכים ותורמים כיום לחקור את הגן הזה, בתקווה לפתח טכניקות גנטיות שונות שתכליתן תיקון - או פיצוי - על הכשל בתפקודו של p53 מכיוון שכאמור, הגן הבודד הזה מעורב בהתפתחותם של כמחצית מכלל הגידולים הסרטניים, עשויות טכניקות פיצוי כאלה לסייע בבלימת חלק ניכר מהמחלות הסרטניות בבני אדם.
בקרת ריבוי תאים
חוקרים במכון ויצמן הראו כי תאים סרטניים שונים מתאפיינים בחוסר יכולת להגיב נכון על "מסרים כימיים" הנשלחים אליהם ומורים להם לחדול מלגדול ולהתרבות. החוקרים גילו קבוצה חדשה של גנים האחראיים לייצורם של חלבונים תאיים שונים, הממלאים תפקיד חשוב בתהליכי התגובה של התאים למסרים הכימיים שנועדו לווסת את תהליכי הגידול וההתרבות של התאים. נראה ש"קילקול" שחל בגנים האלה הוא הגורם לאי-יכולתם של התאים להגיב נכון למסר, דבר שמתבטא בגידול ובהתרבות של תאים ללא בקרה, כלומר, בהתפתחות גידול סרטני.
ההבנה שהושגה במחקרים אלה עשויה לסייע לפיתוח דרכים ושיטות לחיזוק תהליכי הבקרה על התרבות תאים, דבר שמשמעותו יכולה להיות בלימת התפתחותם של גידולים ממאירים.
גנטיקה ולוקמיה
מדעני המכון גילו בכרומוזום 9 ובכרומוזום 22 , שני גנים (ABL ו - BCR) שמתאחים בעקבות שינוי כרומוזומלי ייחודי, ויוצרים בכך גן המקדד חלבון שמוביל להתפתחות לוקמיה מילואידית כרונית. מחקר זה הראה בפעם הראשונה כי התאחות של שני חלבונים יכולה להוות גורם מרכזי וראשוני להתפתחות גידול סרטני.
אותו צוות מחקר זיהה חילופים גנטיים בין הגן 1 - ALL הממוקם בכרומוזום 11, לבין שורה של גנים הממוקמים בכרומוזומים אחרים. כל חילוף כזה מוביל ליצירת חלבון חדש, שהרכבו מוכתב על-ידי שני הגנים המעורבים. חלבונים אלה גורמים - ישירות - להתפתחות לוקמיה חריפה, בעיקר בתינוקות ובחולים שבהם המחלה נבעה מטיפול בתרופות נוגדות סרטן. מדעני המכון ממשיכים במאמציהם להבין את מנגנון הפעולה של החלבון שמקודד בגן 1 - ALL התקין, ושל החלבונים גורמי הסרטן שנוצרים כתוצאה מאיחודו של הגן הזה עם גנים אחרים.
צוות אחר של חוקרים במכון, גילה כי הגן 1 - AML הממוקם בכרומוזום 21, מעורב בהתחוללות לוקמיה בעיקר בלוקים בתסמונת דאון. תסמונת זו נובעת מקיומו של עותק שלישי (ומיותר) של כרומוזום 21 בכל אחד מתאי גופם של הלוקים בתסמונת. מדעני המכון גילו כי קיומו של עותק שלישי של הגן 1 - AML גורם להיווצרות חלבון האחראי להתחוללות לוקמיה מילואידית. נראה כי פגמים שונים בגן זה עלולים להוביל להתחוללות לוקמיה גם בבני אדם שאינם לוקים בתסמונת דאון. תגליות אלה עשויות לסייע בעתיד לפיתוח דרכים לריפוי הלוקמיה המילואידית.
תקשורת וסרטן
במחקר שהתבצע בזבובי פירות, גילו חוקרי המכון תופעה שעשויה לסייע בהבנת ובבלימת הסרטן בבני אדם. המדענים גילו בזבוב הפירות גן שממלא תפקיד בהתפתחות עוברים, וייתכן שגם בתהליכים סרטניים. מדובר בגן השמור היטב במעלה האבולוציה, כלומר, ההבדלים בין הגן הזה בזבוב לבין הגרסאות שלו הקיימות בבעלי חיים מפותחים יותר, לרבות האדם, הוא קטן יחסית. לפיכך, הבנת התהליכים שבהם מעורב הגן הזה עשויה להביא לפיתוח שיטות חדשות לטיפול בסרטן השד ובמחלות נוספות, וכן להבנה טובה יותר של תהליכי התפתחות איברים בעוברים.
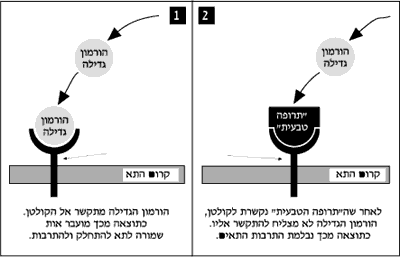
החוקרים בחנו תהליך שבו הורמון גדילה המכונה EGF "מטיל עוגן" ונקשר לקולטן חלבוני מסוים שממוקם על קרום התא. התקשרות הורמון הגדילה לקולטן פותחת תהליך ביוכימי שגורם לתא להתחלק ולהתרבות, או להתמחות בתחום מסוים (עצב, שריר, דם וכו'). כאשר התהליך החיוני הזה מתבצע ללא בקרה מתאימה, עלולה להתחולל התרבות תאים לא רצויה, דבר שמשמעותו התחוללות מחלה סרטנית.
מדעני המכון גילו שהגוף מבקר את התקשורת בין ההורמון לקולטן באמצעות שינויים בשיעורי הייצור של "תרופה טבעית" שמונעת את ההתקשרות הזאת. ככל שיותר מולקולות של הורמון גדילה מתקשרות ליותר קולטנים, מייצר הגוף יותר "תרופה טבעית", שבולמת את התהליך הזה. כך, כאשר מתמלאת המכסה המתאימה של התקשרויות בין מולקולות של הורמון גדילה לקולטנים, מופסק התהליך באופן טבעי. הגן האחראי לייצורה של "התרופה הטבעית" זוהה, ותפקידו במערכת הוסבר והובן לראשונה, הודות למחקר זה.
מחקר זה עשוי להביא לפיתוח תרופות שימלאו את מקומם של החומרים הטבעיים החסרים, או ינטרלו חומרים שמצויים בגוף בכמויות עודפות. תרופות אלה עשויות למנוע את השיבוש בבקרת תהליכי התרבות התאים, דבר שמשמעותו המעשית היא, בלימת המחלה הסרטנית.
הסרטן זקוק לדם
מדעני המכון אישרו שרק לאחר שכלי דם חדשים מתפתחים ומתחילים להוביל חמצן וחומרי מזון אל הגידול הסרטני, יכול הגידול הזה להתפתח ולגדול במהירות. במחקר זה התברר שגידול סרטני חדש (או גרורה סרטנית) שאינם מלווים בהתפתחות של כלי דם, יכולים להתפתח לגודל מרבי של מילימטר אחד בלבד (ובשלב התפתחותי זה, בדרך כלל, הם אינם נוהגים באלימות כנגד הרקמות הבריאות של הגוף). לצורך המחקר פיתחו החוקרים שיטה חדשה למעקב אחר כלי דם באמצעות מערכת דימות בתהודה מגנטית (MRI). שיטה זו עשויה לסייע בהבנה טובה יותר של תהליכי ה"גיוס" של כלי הדם על-ידי הגידול הסרטני.
תהודה מגנטית
מדעני המכון גילו מדוע התרופה טמוקסיפן, המשמשת לטיפול בסרטן השד, מצליחה לבלום את התפתחות הגידול הסרטני באופן זמני בלבד. המדענים גילו כי הטמוקסיפן מונע את פעילות האסטרוגנים (שהם הורמוני מין נשיים סטרואידיים), הגורמים לצמיחתם של כלי דם חדשים, ולפיכך חיוניים גם להתפתחותו של הגידול הסרטני. מדעני המכון, שעקבו אחר התהליך באמצעות דימות בתהודה מגנטית, גילו כי בעקבות הטיפול בטמוקסיפן מתדלדלים כלי הדם באזור הגידול הסרטני, דבר שגורם לבלימת התפתחותו של הגידול. אבל, כעבור זמן מתחדשת צמיחתם של כלי הדם באזור, ובעקבות זאת מתחדשת גם התפתחותו של הגידול הסרטני. מדעני המכון הראו כי התחדשות צמיחתם של כלי הדם מתאפשרת בעקבות פעולתם של מנגנונים שונים שאינם תלויים באספקת האסטרוגן לאזור, ולכן הם אינם מושפעים מהטמוקסיפן.
מבט מבחוץ
מדעני המכון פיתחו שיטה לא חודרנית להבחנה בין גידולים סרטניים (של סרטן השד) לגידולים שפירים. השיטה המבוססת על דימות באמצעות תהודה מגנטית (MRI), והיא עשויה להפחית את מספרן של בדיקות הביופסיה החודרניות, וכן לסייע במעקב אחר יעילותם של טיפולים תרופתיים.
השיטה מבוססת על הזרקת חומר ניגוד לזרם הדם של הנבדק, ומעקב אחריו באמצעות מערכת דימות בתהודה מגנטית (MRI). חומר הניגוד חודר לגידול סרטני ומתפזר בו בקצב ובאופן שונה מהדרך שבה הוא חודר ומתפזר בגידול שפיר. מערכת ה-MRI מזהה את ההבדלים האלה וכך היא מבחינה - באופן בלתי חודרני - בין גידולים סרטניים לבין גידולים שפירים. מדעני המכון פיתחו דרכי מדידה חדשות, המאפשרות קבלת מידע "חד" ומדויק יותר מזה שמתקבל במדידות MRI רגילות.
בנוסף להבחנה בין גידולים סרטניים לגידולים שפירים, השיטה מספקת גם מידע על התפתחותם של כלי דם מיקרוסקופיים באיזור הגידול, דבר שעשוי לסייע בחיזוי קצב התפתחותו של הגידול. יכולת החיזוי נובעת מהעובדה שהתפתחות כלי דם היא תנאי הכרחי להתפתחותם של גידולים סרטניים: כלי הדם משמשים להובלת חמצן ומזון אל תאי הגידול. היעדר דרכי התובלה האלה גורם בהכרח להאטה ואף לבלימת התפתחותו של הגידול. יכולתה של המערכת לבחון גידולים קטנים מאוד, מאפשרת לה להקדים במידה ניכרת את איבחון הגידול.
השיטה מאפשרת גם מעקב אחר גודל המרווחים הבין-תאיים, דבר שעשוי לסייע בבחינת יעילותם של טיפולים תרופתיים. כך, למשל, הפחתה בצפיפותם של כלי דם והרחבת המרווחים הבין-תאיים (שמשמעותה הפחתה בצפיפות התאים באזור), עשויות להעיד על הצלחתו של טיפול תרופתי בבלימת התפתחותו של הגידול.
מגבר מולקולרי לאיתות סרטני
חוקרי המכון גילו את תפקידו של "מגבר מולקולרי" שמחזק את האותות הכימיים הגורמים לתאים להפוך לתאים סרטניים. מגבר זה הוא אנזים המצוי בכמויות גדולות על קרומיהם של תאים סרטניים (בעיקר בסרטן השד, השחלות והריאות). חוקרי המכון הראו שהאנזים (המכונה ErbB-2) "משתף פעולה" עם חלבונים אחרים, שיוצרים יחד מעין "מגבר מולקולרי" המעצים את האיתות הכימי המורה לתא להתחלק - תהליך שעלול להוביל להתפתחות גידול סרטני. ממצא זה עשוי לשמש בסיס לפיתוח שיטת טיפול חדשה בסרטן, שתתבסס על "השתקתו", או על בלימתו של ה"מגבר המולקולרי".
חיסון נגד גרורות
חוקרי המכון ביצעו צעד משמעותי לקראת פיתוח חיסון כנגד סוגים מסוימים של סרטן. המחקר נועד לפתח דרך לבלימת התהליך המסוכן ביותר בהתפתחותה של מחלה סרטנית: היווצרותן של גרורות סרטניות. נקודת המוצא של המחקר היתה הבנת התהליך שבו תאי "משמר הגבול" של המערכת החיסונית (שהם תאי דם לבנים מסוג T) אמורים לזהות - ולהשמיד - תאים סרטניים שנסחפים בזרם הדם בדרכם לייסוד גרורות סרטניות חדשות. במקרים מסוימים נכשלים תאי המערכת החיסונית ואינם מצליחים לזהות את התאים הסרטניים. התברר ש"כשל האבטחה" הזה נובע מ"התחכמות" מסוימת של התאים הסרטניים, המציגים את "שלטי הזיהוי" שלהם ברמה נמוכה מזו הדרושה להפעלת תאי "משמר הגבול".
"שלטי הזיהוי" של התאים הסרטניים הם, למעשה, מבנה מורכב הכולל בין היתר מקטעים שונים של חלבונים שמקורם בתוך התא, המוצגים על פני קרום התא באמצעות חלבון "תואם רקמות". כמה מהמקטעים האלה בתאים סרטניים, שונים ממקביליהם בתאים בריאים (כתוצאה ממוטציה גנטית או מסיבות אחרות). חוקרי המכון גילו מקטע חלבוני כזה, בידדו אותו מתאי גידול של סרטן ריאה, והשתמשו בו בהצלחה כבתרכיב חיסון. כתוצאה מכך, "למדה" המערכת החיסונית לזהות את "שלטי הזיהוי", וכאשר הופיעו לפניה תאים סרטניים שנשאו את אותם ה"שלטים" - גם כשהם מופיעים ברמה נמוכה - היא תקפה והשמידה אותם.
צוות אחר של חוקרים במכון פיתח גישה לייצור של תאי T הורגים, לפי "מיפרט" מבוקש, מחוץ לגוף. גישה זו משלבת טכנולוגיה של נוגדנים חד-שבטיים המכוונים נגד מרכיבים מסוימים של גידולים סרטניים, עם תאי ה - T. בטכניקה זו מובילים הנוגדנים את תאי ה- T אל מטרותיהם. בעתיד עשויה השיטה הזאת לשמש לטיפול בסרטן השחלה, סרטן השד וסרטן המעי הגס.
לוחצים את הסרטן
חוקרי מכון ויצמן למדע מפתחים טכנולוגיה חדשה שבמסגרתה, תאים שיילקחו מגידולים סרטניים יטופלו בלחץ הידרוסטטי וכמו כן יעברו טיפול כימי שייצב את השפעות הלחץ ההידרוסטטי. לאחר הטיפול, תיבחן יכולתם של התאים הסרטניים האלה לשמש בסיס לטיפולים נוגדי סרטן. שיטה זו נבחנת עכשיו בניסויים קליניים (בבני אדם).
ריפוי סרטן עור - באמצעות האור
צוות של מדענים מהמכון פיתח גישה חדשנית להרס גידולים סרטניים, לרבות מלנומה, אחת הצורות התוקפניות ביותר של סרטן עור. טכניקה זו מבוססת על שימוש בנגזרות כלורופיל (חומר צבע צמחי) הנקלטות באופן בררני בתאים הסרטניים. בשלב זה, כאשר מאירים את הרקמה המטופלת (שתאיה קלטו את נגזרות הכלורופיל), מועברת אנרגיה מהפיגמנט הירוק אל מולקולות חמצן שבתא, תהליך שגורם למותו של התא הסרטני. חברות תרופות גדולות בעולם מתעניינות בפיתוח יישומים רפואיים המבוססים על הגישה המקורית הזאת.
איתות סרטני
מדעני המכון בידדו חלבון המכונה MAP2d, העשוי לסייע באיבחון מוקדם של נוירובלסטומה ממאירה (מחלה סרטנית, מן השכיחות ביותר בקרב ילדים, שראשיתה במערכת העצבים ההיקפית).
החוקרים, שהסתייעו בשיטות כימיות ואימונולוגיות, גילו כי MAP2d מצוי בכל תאי הנוירובלסטומה האנושיים, וכי הוא נבדל בבירור מחלבונים דומים המצויים בתאי עצב נורמליים או בגידולים ממאירים מטיפוסים אחרים. לפיכך, עשויה נוכחותו של החלבון הזה לשמש לאיבחון מוקדם של המחלה.
MAP2d קשור למיקרוטובולות - מבנים סיביים המהווים מרכיב חשוב בשלד התאי. המיקרוטובולות מפקחות על תיפקודים תאיים רבים ובכלל זה על הזרימה האקסונלית, ההפרשה, וכן על היפרדות כרומוזומים בתהליך חלוקת התא.