"תמיד ראיתי בעצמי רופא", אומר ד"ר רביד שטראוסמן, בעל תואר כפול MD/PhD, שהצטרף באחרונה למחלקה לביולוגיה מולקולרית של התא במכון. "אך בתקופה שבה סיימתי את הלימודים הלכתי ונמשכתי למח
קר. ועדיין, גם כשאני עוסק במחקר במעבדה, המחשבה שלי נתונה לחולה הזקוק לטיפול". לחולים עליהם חושב ד"ר שטראוסמן יש כיום מעט מאוד תקווה לריפוי, מכיוון שסוגי הסרטן מהם הם סובלים עמידים לכימותרפיה. מדוע גידולים מסוימים מצטמקים בתחילת הטיפול הכימי, אולם מסרבים להיעלם לחלוטין, ואילו גידולים
אחרים משלימים את התהליך עד סופו, אך חוזרים בגירסה עמידה מאוחר יותר? מדוע מתברר שטיפול אשר משמיד לחלוטין תאים סרטניים במבחנה – יעיל הרבה פחות בגוף האנושי?
 ד"ר שטראוסמן החל לחקור את תופעת העמידות של סוגים שונים של סרטן במהלך מחקרו הבתר-דוקטוריאלי במכון "ברוד" של הרווארד ושל המכון הטכנולוגי של מסצ'וסטס. במעבדתו של פרופ' טוד גולוב, המדען הראשי של מכון ברוד וראש התוכנית לחקר הסרטן, הוא חקר שאלה זו מזווית לא שגרתית. בעוד מדענים רבים מחפשים את התשובה בתאים הסרטניים עצמם, באמצעות השוואה בין אלה שמגיבים לכימותרפיה לבין אלה שעמידים אליה, ד"ר שטראוסמן ועמיתיו חשבו שהמפתח להבנת הבעיה נעוץ במקום אחר – בתיפקודם של תאי הגוף הבריאים.
ד"ר שטראוסמן החל לחקור את תופעת העמידות של סוגים שונים של סרטן במהלך מחקרו הבתר-דוקטוריאלי במכון "ברוד" של הרווארד ושל המכון הטכנולוגי של מסצ'וסטס. במעבדתו של פרופ' טוד גולוב, המדען הראשי של מכון ברוד וראש התוכנית לחקר הסרטן, הוא חקר שאלה זו מזווית לא שגרתית. בעוד מדענים רבים מחפשים את התשובה בתאים הסרטניים עצמם, באמצעות השוואה בין אלה שמגיבים לכימותרפיה לבין אלה שעמידים אליה, ד"ר שטראוסמן ועמיתיו חשבו שהמפתח להבנת הבעיה נעוץ במקום אחר – בתיפקודם של תאי הגוף הבריאים.
הסיבה לכך, הוא מסביר, היא שתאים סרטניים, כמו כל תאי הגוף, הם חלק ממערכת גדולה, מתוחכמת ומקושרת, בה מופעלים מנגנונים שונים לעזרה ולתמיכה הדדית. לתאים בריאים יש יכולת להזעיק עזרה מחלקים מרוחקים של הגוף, כמו לשד העצם, כאשר הם נפגעים או מצויים תחת התקפה. המדענים חשדו, כי באופן דומה, התאים הסרטניים מזעיקים עזרה כאשר הם מצויים תחת מתקפה כימותרפית.
על מנת לבדוק השערה זו גידלו החוקרים סוגים שונים של תאים סרטניים, ובחנו את רגישותם לתרופות כימותרפיות. ואכן, הם גילו כי גידולים הנבדקים במבחנה ומכילים אך ורק תאים סרטניים, רגישים ביותר לסוגים שונים של כימותרפיה. אולם, כאשר הוסיפו
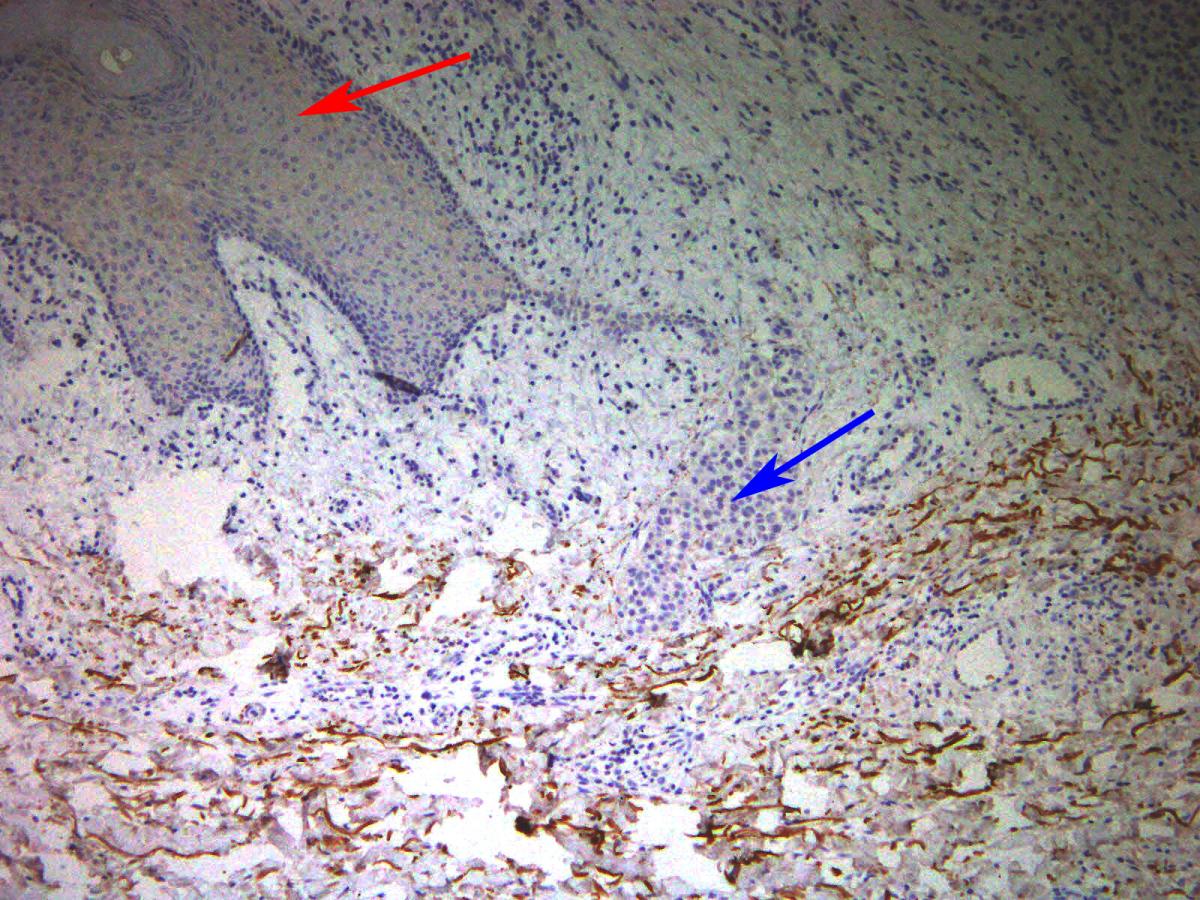
למבחנה סוגים שונים של תאים נורמליים, המצויים באופן רגיל בסביבת הגידול, הרגישות צנחה – ובמקרים מסוימים אף נעלמה לחלוטין. לאחר שמצאו כי תופעה זו מתרחשת בסוגים רבים של סרטן ובסוגים רבים של תרופות כימותרפיות, החליט הצוות להתמקד במלנומה – סוג הסרטן האחראי לרוב מקרי המוות מסרטן עור. הם גילו חלבון המופרש מתאים בריאים מסוימים אשר מצויים בגידול, ומגן על תאי המלנומה מפני אחת התרופות הכימותרפיות המתקדמות ביותר המשמשות כיום לטיפול במחלה זו. החלבון, שהוא גורם גידול המשפיע על תאי כבד (HGF - hepatocyte growth factor), ממלא תפקידים נוספים, בהם החלמה של פצעים.
בהמשך חיפשו המדענים עדויות לפעילותו של החלבון בדוגמאות גידול שנלקחו מחולי מלנומה. או אז הראו התוצאות, שכאשר תאים בסביבתו הקרובה של הגידול ייצרו כמויות גדולות של HGF, הגידול הראה עמידות לכימותרפיה, ואילו חולים שבהם התאים לא ייצרו HGF הפגינו תגובה טובה הרבה יותר לטיפול. מכך עולה כי HGF, כשלעצמו, מסייע להישרדות התאים הסרטניים בתגובה לכימותרפיה. בהתבסס על ממצאים אלה מתוכננים להתקיים בקרוב ניסויים קליניים שבמסגרתם יינתנו מעכבי HGF לחולי מלנומה, ביחד עם הטיפול הכימותרפי הסטנדרטי.
"גידול רגיל מכיל סוגים שונים של תאים – סרטניים ונורמליים כאחד", אומר ד"ר שטראוסמן. "מיגוון התאים הנורמליים המצויים בסביבתו הקרובה של הגידול עשוי לייצר עשרות חומרים שונים, אשר מסייעים לגידול לשרוד את הטיפול הכימותרפי. אנחנו מצויים בתחילתה של הדרך בניסיון להבין מה הם חומרים אלה וכיצד הם מסייעים לעמידות".
אישי
רביד שטראוסמן נולד ברמת-גן, ושירת כקצין בחיל האוויר. הוא סיים מסלול MD/PhD בבית הספר לרפואה של האוניברסיטה העברית בירושלים, ובמעבדתה של פרופ' שושנה רביד. לאחר שנה שבמהלכה עבד בבית-החולים "בילינסון" ביצע מחקר בתר-דוקטוריאלי במעבדתו של פרופ' חיים סידר באוניברסיטה העברית בירושלים. לאחר מכן המשיך למחקר בתר-דוקטוריאלי נוסף במעבדתו של פרופ' טוד גולוב במכון ברוד. "רביד, סידר וגולוב היו מנטורים במלוא מובן המלה", הוא אומר. "זו הייתה זכות גדולה לעבוד לצדם".
רביד נשוי לשרון, אנדוקרינולוגית של ילדים, ואב לארבעה ילדים בגילים שמ-11 עד שנתיים. בזמנו הפנוי הוא נוהג לשחק טניס.
"מאזן אימה" בין גן תקין למוטציה שלו, אחראי לחלק ממקרי הלוקמיה
שרידותם של תאים לוקמיים תלויה דווקא בעותק הנורמלי, הלא מוטנטי, של הגן הגורם ללוקמיה מיילואידית חריפה
תאי לוקמיה מצליחים לעשות את מה שאנשים רבים חולמים לעשות. הם מצליחים לחיות כמעט לנצח. איך הם עושים זאת? מדעני מכון ויצמן למדע גילו שבכרבע ממקרי הלוקמיה, מופעל בתאים הסרטניים "מאזן אימה" פנימי האחראי להישרדותם ולהתרבותם. כאשר גרסה של גן מסוים עוברת מוטציה, הגן שעבר מוטציה הופך לגן מקדם סרטן אונקוגן. אולם מתברר כי דווקא הגרסה המקורית, הנורמלית, של הגן, לצד גרסת המוטציה, היא שמחזיקה את התא הסרטני בחיים, שומרת על אופיו הסרטני ומאפשרת לו לגרום נזק הרסני לגוף. ממצאים אלה התפרסמו באחרונה בכתב-העת המדעי Cell Reports.
הגן שבו מדובר, RUNX1, ממלא תפקיד חיוני בהתפתחות מערכת הדם ובתחזוקתה. הגן מקודד לחלבון המתפקד כגורם שיעתוק: חלבון השולט בהתבטאותם של גנים רבים אחרים. במערכת הדם מנחה RUNX1 את התמיינותם של תאי גזע המצויים בלשד העצם, כך שיתפתחו לסוגים שונים של תאי דם בוגרים. די במוטציה בודדת בגן RUNX1 בתאי גזע אלה, כדי לדרדר אותם במדרון החלקלק המוביל להתמרה סרטנית. דוגמה לכך היא הלוקמיה המיילואידית החריפה (AML), שנגרמת בעקבות סוג מסוים של מוטציה הנגרמת מנדידה של חלק מכרומוזום 8 אל תוך הגן RUNX1, בכרומוזום 21. כתוצאה מכך נוצר גן סרטני (אונקוגן) המבטא חלבון מאוחה, אשר כולל הן מרכיבים של RUNX1 והן מרכיבים שמקורם בפיסה הגנטית הנוספת. החלבון המאוחה הוא הגורם לוקמיה. בתהליך דומה מתפתחת הלוקמיה הנפוצה ביותר בקרב ילדים, ALL.
"החלבון הסרטני המאוחה, המווסת באופן ישיר את פעילותם של גנים רבים, גורם לסדרה של שינויים גנטיים נוספים בתא", אומר פרופ' יורם גרונר מהמחלקה לגנטיקה מולקולרית, שעמד בראש צוות המחקר, ואשר ביצע בעבר מספר מחקרים שהתמקדו בגן RUNX1 ובגנים נוספים המצויים על כרומוזום 21. במחקרים אלה הצליח פרופ' גרונר, בין היתר, לפענח את תפקידו של RUNX1 בלוקמיה התוקפת חולי תסמונת דאון.
את המחקר הנוכחי הוביל החוקר הבתר-דוקטוריאלי ד"ר אורן בן עמי, מקבוצתו של פרופ' גרונר, והשתתפו בו חברי קבוצת המחקר של ד"ר עמוס תנאי מהמחלקה למדעי המחשב ומתמטיקה שימושית וד"ר דינה לשקוביץ מהמרכז הלאומי לרפואה מותאמת אישית, הפועל במכון ויצמן למדע. כהכנה למחקר הנוכחי סרקו המדענים מיגוון מאגרי מידע, והבחינו בתופעה יוצאת דופן: הנתונים הקליניים רמזו כי העותק הנורמלי של הגן RUNX1 – זה שלא עבר מוטציה – נשמר תמיד בתאים הלוקמיים, ופעילותו גבוהה. ידוע כי בכל אחד מתאי גופנו מצויים שני עותקים של כל גן: אחד שמקורו באם ושני שמקורו באב. המוטציות הגורמות לסרטן מתרחשות רק באחד משני העותקים האלה, וגורמות להתפתחות המחלה. העותק הבריא, לעומתו, מושתק בדרך כלל, כך שרק העותק המוטנטי בא לידי ביטוי.
במקרה זה נראה כי העותק הבריא של RUNX1 אינו מושתק בתאים הלוקמיים. עובדה זו העלתה את החשד כי העותק הבריא ממלא גם הוא תפקיד בהתפתחות המחלה. אולם כיצד הוא עושה זאת, ובאיזה שלב? כדי לענות על השאלה גידלו המדענים תאים לוקמיים, שבחלקם הושתק העותק המוטנטי של הגן RUNX1, בחלקם הושתק העותק הנורמלי, ובחלקם שני העותקים פעלו כרגיל. התברר שכאשר העותק הנורמלי מושתק, התאים מתים. לעומתם, התאים בהם שני העותקים פעילים שמרו על אופיים הסרטני. בדיקה מדוקדקת הראתה כי תאים סרטניים אלה הצליחו לחמוק ממסלול של מוות תאי הקרוי אפופטוזיס – מנגנון התאבדות שנועד, בין היתר, למנוע את הישרדותם והתרבותם של תאים הנושאים מוטציות סרטניות. במילים אחרות, נראה כי העותק הנורמלי של RUNX1, ולא העותק המוטנטי, אחראי להישרדותם העקשנית של התאים הסרטניים – אחת מתכונותיהם המסוכנות ביותר.
פרופ' גרונר אומר שהתאים הלוקמיים "מכורים" לגרסה הנורמלית של RUNX1, כלומר, הם תלויים בה באופן פיסיולוגי לצורך הישרדותם. "במהלך הזמן רוכש הגן האונקוגני המאוחה 'מומחיות' בהפיכת התאים לתאים סרטניים. ככל שהתהליך הסרטני התוך-תאי מתקדם, התא זקוק ל'מאזן האימה' בין שתי הגרסאות של הגן כדי להתקיים".
התובנה החדשה מחוללת מהפכה בהבנת הלוקמיה. המדענים סבורים כי התגלית המפתיעה תוביל לפיתוח שיטות מתקדמות, יעילות ומדויקות, לאיבחון סוגים אלה של לוקמיה, ולטיפול במחלה.
מידע נוסף ותמונות אפשר לקבל במשרד דובר מכון ויצמן למדע: 08-934-3856