עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
הירשמו לניוזלטר החודשי שלנו:
עיתונאיות ועיתונאים, הירשמו כאן להודעות לעיתונות שלנו
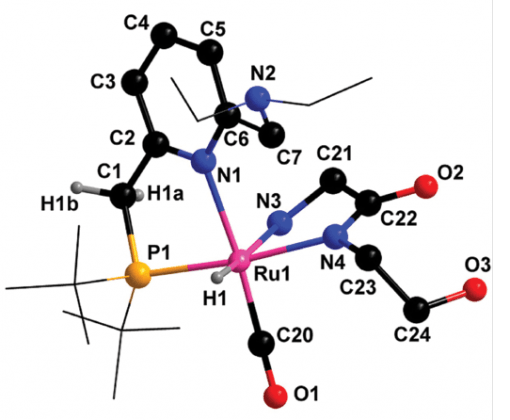
שיקולי בטיחות ונצילות הם לא פעם מחסום משמעותי בפני שימוש במימן כדלק יעיל, לא מזהם וידידותי לסביבה, ואחסונו. פרופ' דוד מילשטיין ושותפיו למחקר השתמשו בזרז שתיכננו כדי לפתח מערכת חדשה להפקה ולהעברה של מימן. מערכת ההעברה מבוססת על נוזל אורגני – אתנול אמין – אשר יכול לאחסן ולשחרר מימן באופן כימי, ואף לחדשו בקלות. בתמונה נראה מכלול הרותניום אשר מעורב בתהליך הזירוז.

תמונה זו מדגימה את תופעת המיון על-פי תכונת הספין (סיחרור) של אלקטרונים. מולקולות כיראליות, שהן בעלות סימטריה דמויית-בורג, כלומר ספירלה המכוּונת ימינה או שמאלה, יכולות לשמש להעברה בררנית של אלקטרונים בעלי ספין בכיוון מסוים. "מסנני ספינים" כאלה, שמציעים פרופ' רון נעמן ושותפיו למחקר, עשויים להיות שימושיים בתחום הספינטרוניקה, ולאפשר פיתוח התקנים חדשים לאיחסון מידע ולביצוע חישובים שיתבססו על הספין של האלקטרונים במקום על המטען החשמלי שלהם.
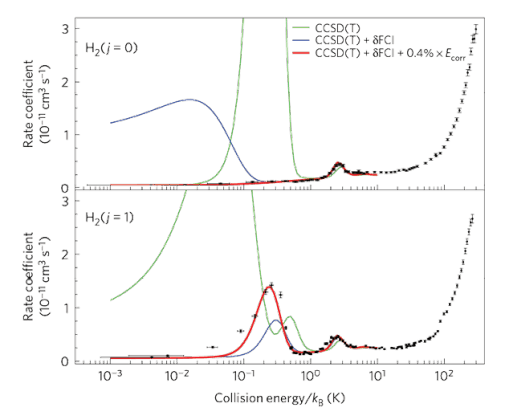
התנגשויות בין מולקולות – המכתיבות קצב של תגובות כימיות – אינן התנגשויות בין שני "כדורים" עגולים. אבל בטמפרטורות נמוכות מאוד, בהן נכנסות לפעולה תופעות קוונטיות, מתערערת תמונה זו, והמצב הסיבובי של המולקולה הוא אשר מכתיב את "צורתה". באיור זה מראים פרופ' אדוארדס נרייביצ'יוס ושותפיו למחקר, כי מולקולות מימן במצב מעוּרר מבחינת האנרגיה הסיבובית שלהן מגיבות אחרת מאלו שמצויות במצב היסוד, וכך למעשה נוצר מעין "מתג" אשר מאפשר מעבר בין שתי הצורות.

מחקר טרום-קליני כרוך לעיתים קרובות בדימות איברים פנימיים של בעלי-חיים קטנים, לפעמים בימים שונים ובשיטות שונות. פרופ' מיכל נאמן ושותפיה למחקר פיתחו שיטה אוטומטית לזיהוי ולהגדרה של רקמות או איברים, באמצעות חישוב שמתבסס על עוצמת האותות מאזורים שונים בדימות. שיטה זו איפשרה מיזוג נתונים ממערכות דימות שונות כגון CT- ו MRI וכן מתמונות כגון שצולמו בימים שונים, ויצרה בכך דימות משולב.
כמה זמן נמשך תהליך ההעתקה של המידע הגנטי של גן מסוים אל המולקולה הארוכה והמורכבת המוכרת כאר-אן-אי שליח (mRNA)?פרופ' משה אורן, פרופ' עידו עמית ושותפיהם למחקר פיתחו שיטה למדידת קצב הייצור של מולקולות אלה, בתאים חיים ובקנה-מידה גדול. במסגרת השיטה צריך להפסיק את התהליך בשלב ההתארכות של השיעתוק, להוסיף תג, ואז לאפשר לתהליך להימשך. הפקת אר-אן-אי בנקודות זמן שונות ובדיקת התקדמות הגדיל המסומן, מספקות קצב כללי הנכון לגנים רבים.
כדי לבצע שיחזור חזותי של עצם מוסתר, מבזיקים פרופ' דן אורון ושותפיו למחקר אור על חלק מהעצם המוסתר, ואז בוחנים את ההתאבכות בין גלי האור אשר מתפזרים ממנו. באיור נראות התצורות המקודדות בדגם ההתאבכות בין שתי מדידות חלקית, כאשר העצם מואר באופן חלקי. מדידות אלה מאפשרות את שיחזור התמונה (כאן אלו הן האותיות WIS, אשר אינן מוצגות).
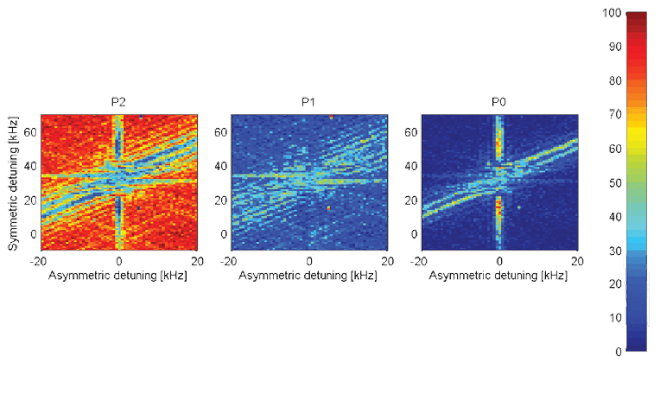
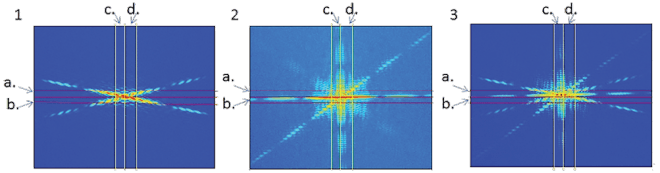
פרופ' רועי עוזרי ושותפיו למחקר השתמשו בלייזר דיאודי, ויצרו באמצעותו שער לוגי, אחד המרכיבים הבסיסיים של מחשב קוונטי – בהסתמך על שני יונים אטומיים שליליים לכודים. השער מיועד להפיכה של ביט קוונטי אחד – לפי מצבו של ביט קוונטי אחר. פעולה זו מחייבת קיום אינטראקציה בין שני הביטים הקוונטיים, כלומר, עליהם "לחוש" זה את זה. בכך מייצג השער מצבים שזורים. שלוש התמונות, המבוססות על מידע ניסיוני, מייצגות, באמצעות הצבעים, את הסבירות (אדום - סבירות גבוהה, כחול - סבירות נמוכה) שהביטים הקוונטיים יימצאו במצבים , הבאים (משמאל לימין): מצב ה- 00 , מצבי ה 01- ו 10- ומצב ה 11- , בהתאם לנתוני השער הלוגי.
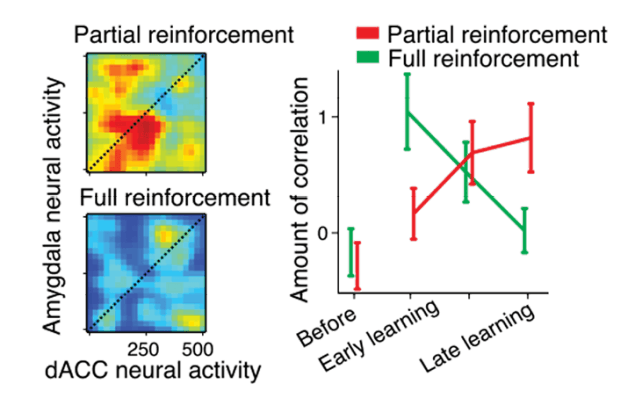
כדי להבין את מעורבות הרגשות בלמידה ובזיכרון בוחנים פרופ' רוני פז ושותפיו למחקר את הקישוריוּת בין אזורים שונים במוח. במחקר זה הם התמקדו בקשר בין האמיגדלה לבין איזור בקליפת המוח הקדמית הקרוי ACC. הם חקרו סוגים שונים של חיזוקים שליליים: חיזוק חלקי, שהוא גירוי מפתיע שאי-אפשר לצפותו, וחיזוק שלילי מלא, שניתן לחזותו ולהתכונן אליו. במחקרם נמצא, שהחיזוק החלקי והמפתיע מוביל לזיכרון עמיד יותר שקשה למחוק אותו, והמנגנון הפיסיולוגי שתורם לכך הוא קישוריוּת בין שני האזורים ותזמון של פעילותם. מנגנונים אלה יכולים למלא תפקיד בתסמונת הפרעת דחק פוסט-טראומטית(PTSD)
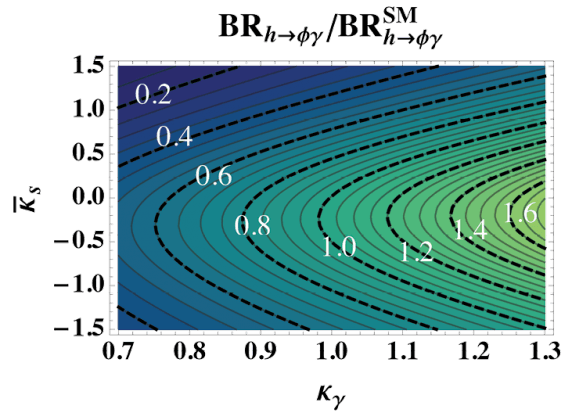
גילוי חלקיק ההיגס במאיץ ההדרונים הגדול (LHC)מאשר את התיאוריה המקובלת בדבר הדרך שבה חלקיקים הנושאים את הכוח האלקטרו-חלש מהווים את מקור המאסה, אולם שאלות אחרות באשר למקורות המאסה של חלקיקי החומר (פרמיונים), וכן ביחס לקיומה של היררכיית-על בין שלושה הדורות של הקווארקים, נותרו ללא מענה. פרופ' גלעד פרז ושותפיו למחקר הציעו דרך לשימוש במאיץ, כדי לחקור את צימוד ההיגס לקווארקים הקלים, דבר שנחשב למקור המאסה שלהם. זאת, על אף העובדה שמדענים רבים סברו שמדידה כזאת אינה בת-ביצוע בסביבה ה"רועשת" של ה-LHC.
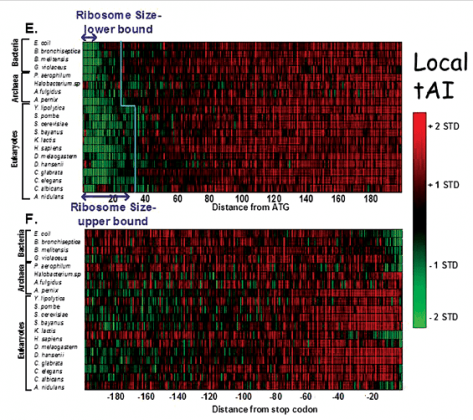
מספר ריבוזומים נעים במורד גדיל אר-אן-אי שליח בבת אחת, ומתרגמים את הצופן הגנטי לחלבון תוך כדי תנועה. אך מה מונע היווצרות "פקקי תנועה" בדרך? פרופ' יצחק פלפל ושותפיו למחקר מצאו צופן אשר מאט את תהליך התרגום בתחילתו, ופועל כמעין רמזור השולט על הכניסה לנתיב תחבורה. תמונה זו מתארת את האבולוציה של הצופן, ומראה את מהירות תרגום mRNA שונים(ירוק – קצב איטי, אדום – קצב מהיר).

אדמה, חול, סלעים, או מכיתות זכוכית הם חומרים אמורפיים הנתונים בלחץ. חישוב הכוחות בין החלקיקים של החומרים האלה, על-פי מיקום החלקיקים בלבד, נחשב בעיה בלתי-פתירה, מפני שכל מה שידוע הוא שסכום הכוחות על כל חלקיק חייב להיות אפס. חישוב כל הכוחות על כל החלקיקים מתחיל ממספר החלקיקים (שהוא מספר התנאים במערכת). אבל על כל חלקיק פועל יותר מכוח אחד, ומספר הכוחות שצריך לחשב שווה למספר החלקיקים, כפול מספר החלקיקים השכנים שיש – בממוצע – לכל חלקיק . לכן יש יותר נעלמים מתנאים. פרופ' איתמר פרוקצ'יה ושותפיו למחקר הצליחו לפתור את הבעיה, בכוח המחשבה והתיאוריה. בתמונה: ציור של מערכת ניסיונית שאיפשרה לאשש את הפתרון שהציעו המדענים. המערכת בנויה מדיסקים פלסטיים, שכאשר לוחצים אותם, הם מסובבים אור מקוטב – באופן יחסי (הטיית האור המקוטב גדלה ביחס ישר למידת הלחץ על הדיסקים). בדרך זו אפשר "לראות" את שרשרות הכוחות שפועלים בין החלקיקים, דבר שאיפשר למדענים להשוות תיאוריה לניסוי.
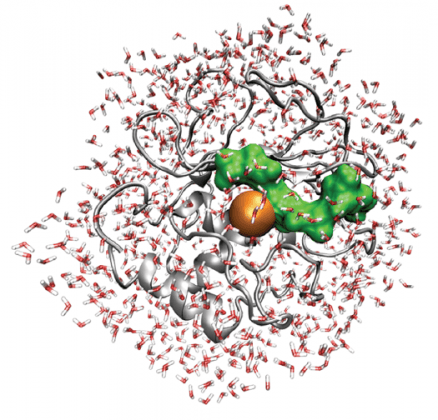
בתמונה זו מוצגים המודל המבני האטומי של האנזים MT1-MMP (סרט אפור), מצע הקולגן שלו (ירוק), וכן מולקולות מים שמסביב ("מקלות" באדום/לבן). בסדרה של ניסויים חשפו פרופ' אירית שגיא, ד"ר מרטינה הבנית ושותפיהן למחקר את הדינמיקה של משפחת פרוטאזות זו – אנזימים אשר חותכים חלבונים – והראו כיצד בדיוק משפיעות מולקולות המים הקטנות שבסביבתם על הקינטיקה שלהם. ממצאים אלה עשויים לסייע בתכנון של תרופות לחסימת אנזימי פרוטאזות מסוימים; למשל, כאלה אשר מסייעים לתאים סרטניים בייסוד גרורות.
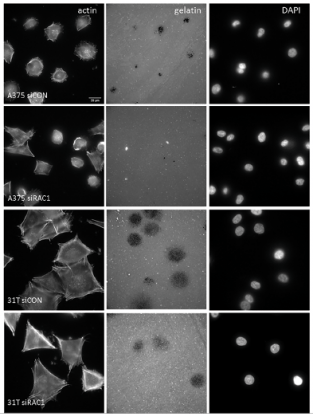
תאים גרורתיים מפרקים את סביבתם הקרובה כדי להשתחרר ולצאת לדרכם לייסוד גרורות. בתמונה: בתאים מחולה מלנומה, שנצבעו בצביעת אקטין (משמאל), הנמצאים על מרקם בין-תאי המסומן פלואורוסצנטית, נראים פירוק משמעותי של המרקם, בתמונה האמצעית (חורים שחורים), וגרעיני התאים (מימין). פרופ' ירדנה סמואלס, פרופ' בני גיגר ושותפיהם למחקר גילו, שאינוואדופודיה(invadopodia) בליטות של תאי סרטן הנחוצות לפירוק המרקם שסביבם – מבוקרות על-ידי אחד הגנים המשפיעים על התקדמות המלנומה RAC1.
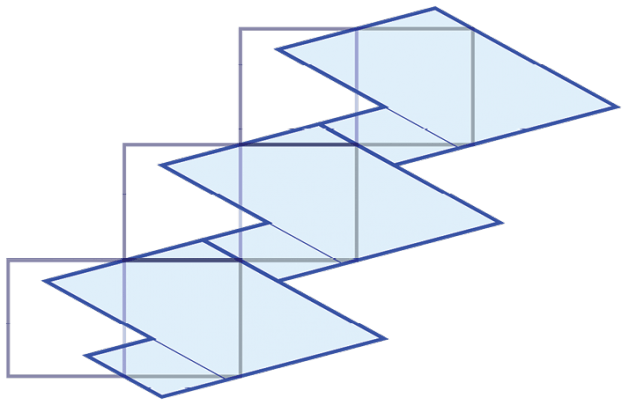
לוקחים מעגל, מחלקים אותו לשני חצאים שווים, בוחרים באקראי נקודה מסוימת עליו (X) ומתחילים לסובב את הנקודה בזווית קבועה אלפא. בכל פעם שהנקודה הנעה נופלת במחצית אחת, עושים צעד לשמאל, ובכל פעם שהנקודה נופלת במחצית השנייה, עושים צעד לימין. זהו "הילוך אקראי"(random walk ) בתרשים, הלקוח ממחקרם של פרופ' עמרי שריג ושותפיו למחקר, מוצגות שתי דרכי ייצוג מתוך אפשרויות אין-סופיות להזזה של משטחים.
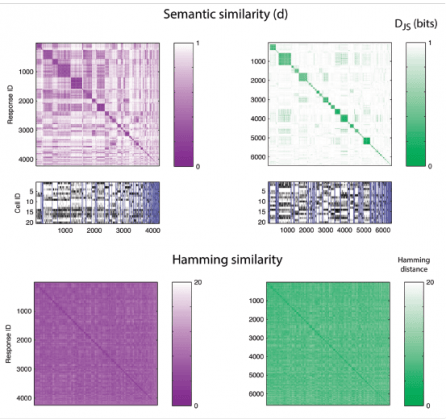
תאי עצב מתַקשרים ביניהם במעין שפה הכוללת צורות ביטוי נרדפות. פרופ' אלעד שניידמן ושותפיו למחקר בחנו את הארגון הסמנטי של קבוצות נוירונים מרשתית של סלמנדרות שצפו בסרט מלאכותי (משמאל) או בסרט טבעי (מימין). למעלה: תבנית הדמיון בין תגובות לאותו גירוי. המדענים השתמשו באלגוריתם אשכולות כדי לגלות את הדפוסים הדומים ביותר ולמיין אותם, וחשפו "מילים נרדפות". בתחתית התרשים, אוכלוסיות של "קוצים עצביים" (בשחור) המתאימים לעמודות התבנית שמעליהן. למטה: תבנית אינטואיטיבית של "חפיפה סמנטית" אשר אינה חושפת מילים נרדפות, המראה כי למוח שלנו יש שפה "זרה" משלו, שאינה מתאימה לשפות המדוברות שלנו.
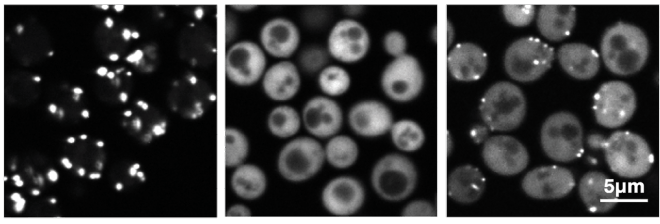
פרופ' מאיה שולדינר ושותפיה למחקר גילו את החלבון PEX9 וחשפו את תפקידו בתוך אברון בתא הקרוי פרוקסיזום. באברון זה נשרף שומן ומומר לאנרגיה. כאשר אברון זה אינו מתפקד, התוצאה יכולה להיות מחלה נוירולוגית הרסנית. באמצעות מערכת רובוטית במעבדה גילו המדענים, שתפקיד ה-PEX9 הוא להכניס חלבונים חדשים מסוימים לתוך הפרוקסיזום. בתמונה, לחלבון פלואורוסצנטי ירוק נוספה פיסת חלבון אשר סומנה באמצעות PEX9 שהתחבר אליו. כאשר PEX9 מבוטא ביתר בתרבית תאים (מימין), אפשר להבחין בקלות בסימון/מיקוד שהוא מבצע לגבי חלבון המטרה.
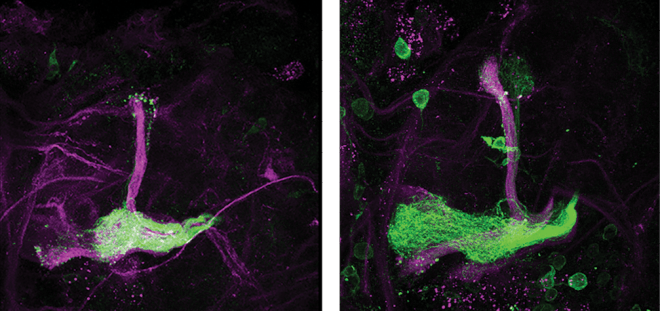
בתהליך ההתפתחות, תאי עצב שולחים שלוחות ארוכות שחלקן "נגזמות", ולאחר מכן צומחות מחדש כדי ליצור את הרשת העצבית התיפקודית. בזמן חקירת תהליך זה בתאי עצב של זבובי פירות (דרוזופילה), אשר מתחולל בהם תהליך של גדילה, ניוון, ושוב התחדשות, גילו פרופ' אורן שולדינר ושותפיו למחקר כי הגז תחמוצת החנקן, NO, פועל כמתג הקובע איזה תהליך יתחולל – ניוון או גדילה. בתמונה: איזור במוח זבוב הפירות שבו גדלו היטב השלוחות האקסונליות (בירוק) שנחשפו לרמות נמוכות של NO (מימין), בעוד אלה שנחשפו לרמות גבוהות של NO לא גדלו היטב. פרופ' שולדינר מציין, כי התהליך חולק קווי דמיון עם תיקון עצבי בעקבות פציעה.
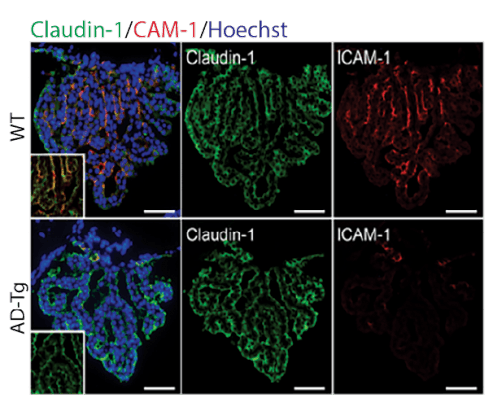
פרופ' מיכל שוורץ ושותפיה למחקר גילו, שבין המוח לבין המערכת החיסונית ישנו ממשק ייחודי אשר מאפשר תקשורת בין שתי מערכות אלו, ותומך בכניסה מבוקרת של תאי המערכת החיסונית אל המוח לצורך תחזוקה, ובעת הצורך – גם למטרות ריפוי. תיפקודו של ממשק זה מווּסת על-ידי המערכת החיסונית, ויכול להיות גורם מרכזי במחלת אלצהיימר ומחלות ניווניות נוספות של המוח. בתמונה נראים תאים של המערכת החיסונית בעת מעברם למוח דרך ממשק זה.
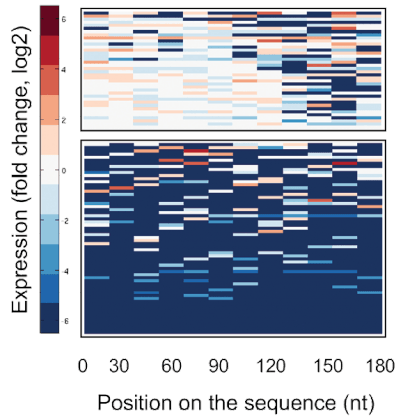
פרופ' ערן סגל ושותפיו למחקר ביקשו לבחון מה הם המאפיינים של מולקולות אר-אן-אי שליח (mRNA). המושכים אליהם את הריבוזומים, אשר מתרגמים את המולקולות האלה ובונים לפיהן חלבונים. כדי לעשות זאת, הם יצרו באר-אן-אי השליח מוטציות שונות, ובחנו כיצד הריבוזומים מגיבים אליהן. כל טור בתמונה זו מייצג מקטע של אר-אן-אי שליח המכיל מוטציה. בכחול מסומנים המקטעים אשר משפיעים ביעילות על יצירת חלבונים – כלומר, הם מושכים אליהם ריבוזומים.

אפשר לייצג את ההיסטוריה התאית של האורגניזם, מאז שהיה ביצית מופרית ועד כל רגע נתון, באמצעות עצי משפחה. פרופ' אהוד שפירא ושותפיו למחקר פיתחו שיטה לשיחזור שושלות תאים באמצעות בחינת מוטציות באזורים בגנום שמאופיינים בשוֹנוּת רבה. באיור נראה עץ משפחה של תאים מן המעי הגס בעכבר, המיוצגים באמצעות נקודות ורודות; הקווים מציינים את הקשרים בין הצאצאים.

שיטות מתקדמות של ספקטרומטריית מסות איפשרו לפרופ' מיכל שרון ולשותפיה למחקר לגלות תת-יחידה חדשה של המכונה התאית הקרויה סיגנלוזום, אשר מבקרת את התהליך שבו חלבונים "מסומנים" ביוביקוויטין לצורך מיונם ומיחזורם. תת-היחידה החדשה (CSNAP) נוספת לשמונה תת-היחידות המוכרות של מכלול חלבוני חשוב זה, וממצאי המחקר מלמדים שתת-היחידה, שבמשך עשורים לא היה ידוע על קיומה, היא חלק מרכזי ממנגנון הסיגנלוזום.

היכולת לראות מבעד לעור – באמצעות מיקרוסקופ – תוכל לסייע לביולוגים להבין תהליכים שמתחוללים בתוך היצור החי. זה בדיוק מה שמסוגלת לאפשר שיטה שפיתחו פרופ' ירון זילברברג ושותפיו למחקר. בתמונה: A - תמונה רגילה שצולמה במיקרוסקופ שני-פוטונים של גוף שנצפה דרך מפזר אור(B(diffuser -אותו גוף לאחר שהתמונה עברה אופטימיזציה; C - תמונת הגוף ללא "עור" שחוסם אותו, לצורכי השוואה. קנה-מידה: 100 מיקרון.
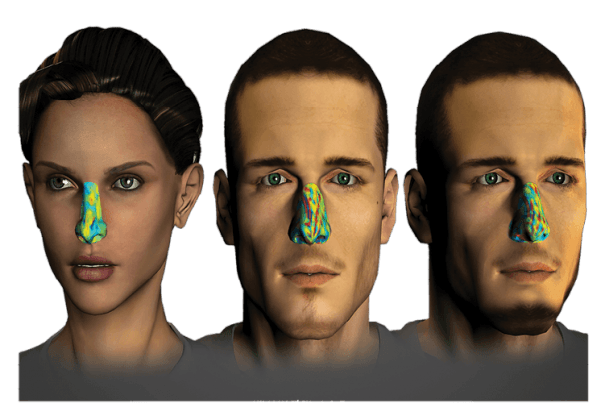
בתמונה: ביטוי חזותי של "טביעת האצבע" הריחית הייחודית לאדם מסוים, כפי שהיא עולה ממחקריהם של פרופ' נועם סובל ושותפיו למחקר. "טביעת אצבע" זו מבוססת על תבנית הדמיון התפיסתי של ריחות, והיא מבטאת את המאפיינים הייחודיים של הדרך שבה אותו אדם תופס ריחות. במחקר זה התברר שכל אדם תופס ריחות באופן ייחודי לו, בהתבסס, בין היתר, על נתוניו הגנטיים. האיור, מעשה ידי עופר פרל, מראה דמיון רב בין תפיסת הריח של אדם מסוים בזמן אמיתי, לבין תפיסת הריח שלו לאחר 30 ימים (מימין). לעומת זאת, תפיסת הריח של האדם שמשמאל, שונה בתכלית. לפי המחקר הזה, בחינה שמבוססת על 35 חומרי ריח, יכולה לשמש לזיהוי "טביעת האצבע הריחית" של כל בני-האדם בעולם.
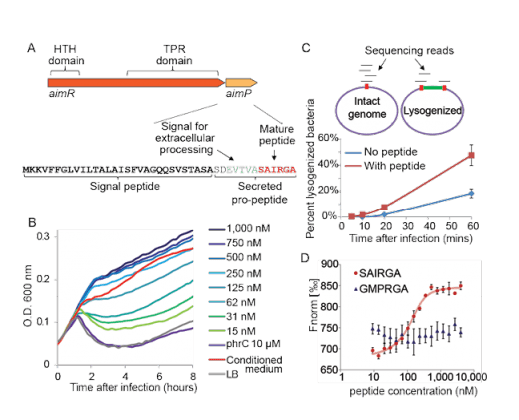
נגיפים רבים יכולים לבחור בין שני מצבי פעולה: התקפה ישירה ומהירה, או מצב רדום. במחקרם על פאג'ים – נגיפים שתוקפים חיידקים – מצאו פרופ' שורק ושותפיו למחקר, שנגיפים מקיימים ביניהם תקשורת המסייעת להחלטות באשר לדרך הפעולה. פפטיד שהמדענים קראו לו ארביטריום מופרש אל הסביבה עבור הדורות הבאים של הנגיף, כדי לאפשר להם "לבחור" באסטרטגיה המתאימה ביותר, לפי התקדמות תהליך ההדבקה.

בתמונה: הדגמה של חוטים קוונטיים מצומדים בשדה מגנטי. מחקר תיאורטי זה, של פרופ' עדי שטרן, פרופ' יובל אורג ושותפיהם למחקר, מתחקה אחר הדרך שבה אינטראקציות בין אלקטרונים, ובינם לבין השדה המגנטי, מובילות להיווצרות חלקיקים מדומים, אשר בנויים ממספר אלקטרונים, אך נושאים מטען שהוא שבר ממטען האלקטרון. מטענים שבורים כאלה עשויים, בין היתר, לאפשר חישוב קוונטי ואיחסון מידע בעתיד.
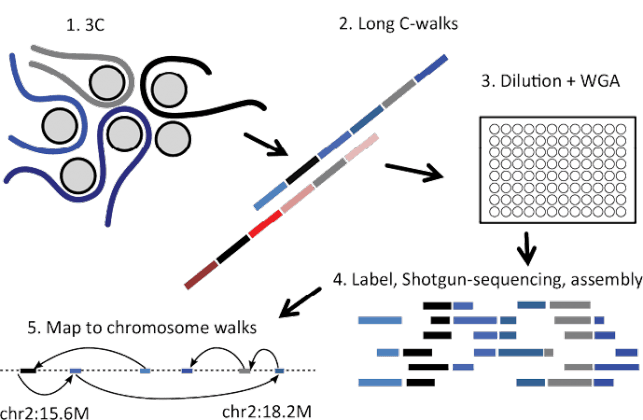
גנים, במצבם ה"ארוז" בכרומוזומים שבגרעין התא, עשויים לבצע חילופי מידע עם שכניהם הקרובים. לתופעה זו עשויות להיות השלכות על האורגניזם השלם, למשל, בהתפתחות מחלה. כדי להבין אילו גנים משפיעים הדדית, וכיצד הם עושים זאת, קיבעו פרופ' עמוס תנאי ושותפיו למחקר רכיבים כרומוזומליים, בודדו מהם מקטעי די-אן-אי, והכניסו סימון "ברקוד" של די-אן-אי לתוך המקטעים. שיטות ריצוף בתפוקה גבוהה ומידול ממוחשב איפשרו להם לזהות גנים שונים אשר הופיעו יחד בניתוח המקטעים, כלומר גנים שקיימו ביניהם פעילות גומלין.

לננו-חלקיקים דמויי-פולרנים ולננו-צינוריות, אשר בנויים מתרכובות אי-אורגניות, יש כבר כיום יישומים רבים – בעיקר כחומרי סיכה מוצקים. בעתיד, הם עשויים לשמש גם בטכנולוגיות רפואיות, בחיזוק פולימרים מרוכבים ליצירת חומרים "חכמים", ועוד. אילוח – הוספת כמויות מזעריות של יסודות זרים – משמש לשליטה בתכונותיהם של מוליכים-למחצה, ונראה שהוא ימלא תפקיד גם ביצירת ננו-חומרים חדשים. בתמונה זו, שצולמה במסגרת המחקר שביצעו פרופ' רשף טנא ושותפיו למחקר, באמצעות מיקרוסקופ אלקטרונים חודר ברזולוציה גבוהה, נראה ננו-חלקיק דמוי- פולרן של MoS2, מאולח בכמות קטנה של אטומי רהניום, דבר שמקנה לו תכונות כימיות ופיסיקליות ייחודיות, וכן כושר סיכה מעולה.
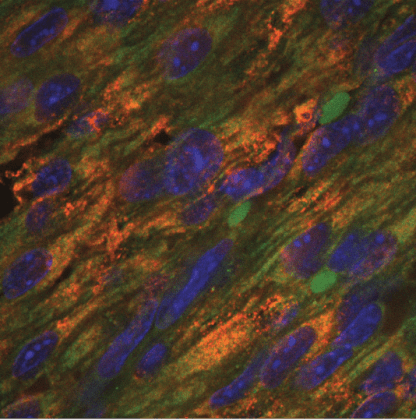
במקטע מלב של עכבר בן יום אחד נראים הקולטן ERBB2 (באדום), טרופונין לבבי (בירוק), וגרעיני תא (כחול). פרופ' אלדד צחור ושותפיו למחקר מצאו, כי ERBB2 מעורב בגדילה של הקרדיומיוציטים, תאי שריר הלב, ובהתחדשותם. רמות הקולטן יורדות זמן קצר לאחר הלידה. בעכברים שלגופם הוכנס מחדש חלבון זה לאחר פגיעה בלב, ניכרה התחדשות הלב.
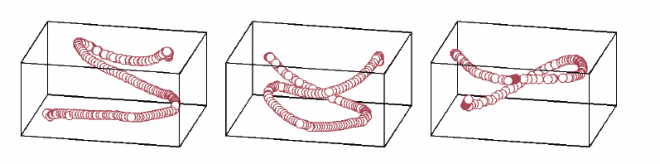
כיצד מצליחים עטלפים לנווט את דרכם במרחב? מיפוי תלת-ממדי של מסלולי התעופה של העטלפים (בתמונה), ומעקב אחר תאי העצב במוחם בזמן שהם מנווטים אל יעדם, איפשרו לפרופ' נחום אולנובסקי ולשותפיו למחקר לגלות באיזור ההיפוקמפוס של מוח העטלף "תאי מקום", אשר מייצגים את כל צירי המרחב באופן שווה, ובאותה רזולוציה חדה.
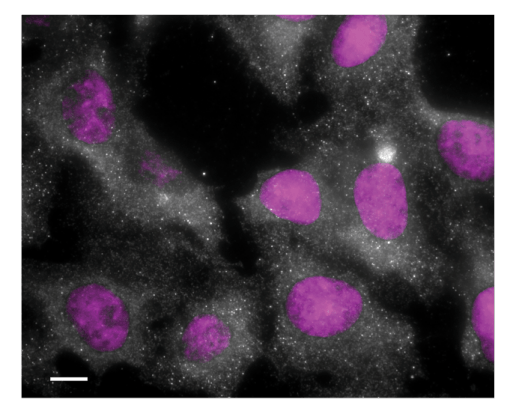
ד"ר איגור אוליצקי ושותפיו למחקר גילו מולקולת אר-אן-אי ארוכה, שאינה נושאת מידע לבניית חלבון, אשר פועלת בתוך הציטופלזמה של התא, כפי שאפשר לראות בנקודות שבתמונה זו (הגרעין צבוע בכחול). מולקולה זו, הקרויה NORAD, מגבירה את ביטויין של מולקולות אר-אן-אי אחרות, בעיקר כאלו המבקרות גנים שמעורבים בחלוקת התא; מחיקת NORAD גורמת להצטברות של תאים שבהם קיים מספר לא תקין של כרומוזומים.

איך אפשר לזהות עצמים בתמונות מטושטשות או חלקיות? פרופ' שמעון אולמן ושותפיו למחקר גילו שקיימת יחידה "אטומית" של זיהוי אשר, באופן בסיסי, זהה עבור כולנו. שינוי פעוט בתמונה הופך אותה מניתנת-לזיהוי ללא ברורה. דבר זה מודגם בתמונות. למטה משמאל: דמות הנשר (מסומנת בתמונה שלמעלה, במסגרת אדומה), ממוקמת, מבחינת יכולתנו לזהות אותה, בגבול התחתון. התמונה למטה במרכז מראה פרשנות של נבדקים שונים באשר לפרטים שהצליחו לזהות בתמונה. המסגרות הצבעוניות, למטה מימין, מייצגות תמונות "אטומיות" נוספות מאותו הנשר. מחקרים אלה עשויים לתרום להבנה טובה יותק של מערכת הראייה, וכן לפיתוח מערכות של ראייה ממוחשבת.
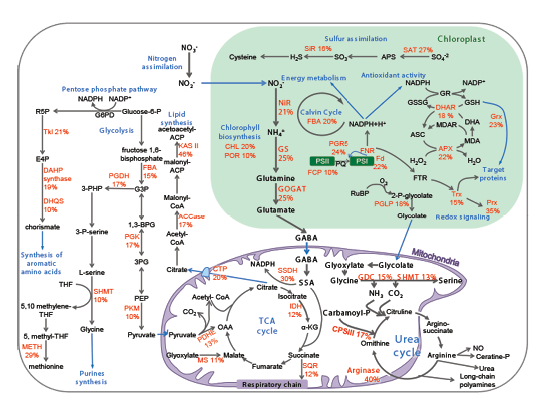
פרופ' אסף ורדי, ד"ר שילה רוזנווסר ושותפיהם למחקר בוחנים את הפיטופלנקטון אשר חיים בימים ובאוקיינוסים, ואת הקשר בינם לבין שינויים אקלימיים. בתמונה: מיפוי מיקומם של אנזימים הרגישים לחימצון במסלולים מטבוליים מרכזיים של אצה ממשפחת הצורניות, הממלאת תפקיד מרכזי באקולוגיה של הסביבה הימית. שינוי בפעילות האנזימים האלה (כתוצאה מעקה חימצונית) מאפשר הסתגלות מהירה לתנאי סביבה משתנים. הבנת המנגנון המולקולרי הזה עשויה לסייע בהבנת תופעות של פריחות ענק באוקיינוסים.

פרופ' סטיב ויינר, ד"ר יותם אשר, ד"ר אליזבטה בוארטו, ושותפיהם למחקר ביצעו תיארוך באמצעות פחמן רדיואקטיבי, בממצאים שהתגלו באתר הארכיאולוגי תל אל-סאפי (שיש הסבורים שבו התקיימה, בתקופת הברזל, העיר הפלישתית גת); ובאתר קובור אל וליידה. המדענים גילו, כי הפלישתים הופיעו באתר מוקדם יותר מכפי שהעריכו עד כה – בסוף המאה ה 13- לפנה"ס. בתמונה: חתך של חלק מהאתר, החושף כמה מהשכבות שממצאים מהן עברו תיארוך. למטה בצד ימין: תמונה מוגדלת של משקעים.
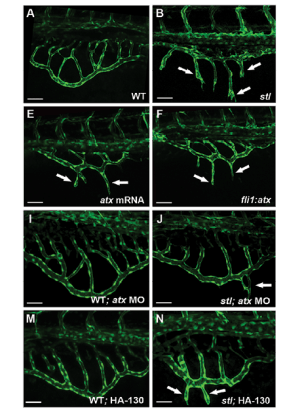
מכלולי חלבון-שומן שנושאים כולסטרול וטריגליצרידים בדם, הקרויים ליפופרוטאינים, ממלאים תפקידים רבים בגוף. ד"ר קרינה יניב ושותפיה למחקר חקרו את תפקידי הליפופרוטאינים בתהליך צמיחתם של כלי דם חדשים. בתמונות: מוטציה במערכת תגובות השרשרת התוך-תאיות של הליפופרוטאין גורמת לצמיחתם המוגזמת של כלי דם בעובר של דג זברה. ניסויים אלה הובילו את החוקרים לגילוי Atx, גן אשר מתווך מערכת זו, ומעניק תובנות חדשות לגבי הקשר בין שומנים לבין היווצרות כלי דם.
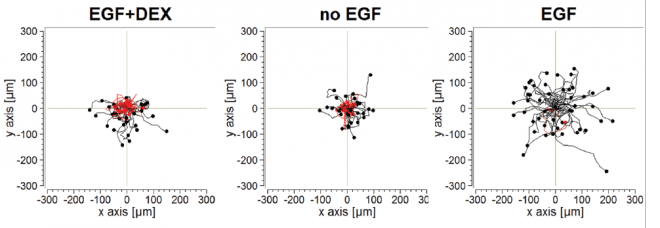
אחד מסימני ההיכר של סרטן אלים הוא "חטיפה" של גורמי גדילה בידי הגידול הסרטני. פרופ' ירדן ושותפיו למחקר החליטו לבדוק האם גורמי גדילה אלה, כמו חומרים רבים אחרים בגוף, קשורים לשעונים הביולוגיים שלנו. כך גילו, שגורמי גדילה רבים פעילים בעיקר בשעות הלילה, שכן בשעות היום מעכב את פעילותם ההורמון קורטיזול. שלושת האיורים מראים כיצד גורם גדילה (EGF) מגביר נדידה של תאים, וכיצד קורטיזול (DEX) בולם אותה. המסקנה: תרופות נוגדות סרטן שמדכאות את פעילותם של גורמי גדילה עשויות להיות יעילות יותר בלילה.
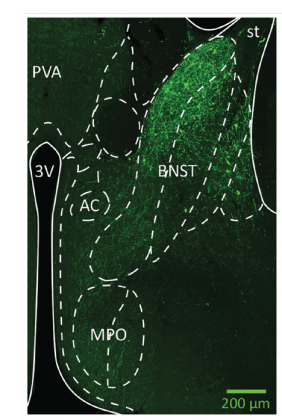
השימוש באור כדי לשלוט בתאי עצב במוחם של עכברים חיים – אופטוגנטיקה – מאפשר לד"ר עפר יזהר, לפרופ' אלון חן ולשותפיהם למחקר להפעיל ולכבות את התאים, ולהבין כיצד הם מתחברים לאזורים אחרים במוח. בתמונה זו, סימון תאי עצב באיזור הגרעינים הבזאליים של הסטריאה טרמינ־ ליס בחלבון פלואורוסצנטי, הביא לגילוי הפעלתם בהתנהגויות שקשורות להתאוששות מעקה ולהתמודדות עם חרדה.
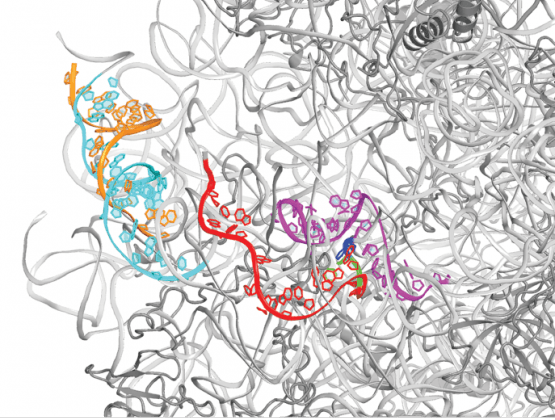
סוגי אנטיביוטיקה רבים מכוונים לתקיפת הריבוזומים בחיידקים, על מנת למנוע מהם לייצר חלבונים. באיור נראה השלד (באפור) של תת-היחידה הגדולה של הריבוזוםשל החיידק S. aureus, גורם מחלה נפוץ אשר מגלה לעיתים עמידות נגד מיגוון סוגי אנטיביוטיקה. הצבעים מתווים את אזורי האר-אן-אי הריבוזומלי בעלי מבנה השונה מזה של חיידקים שאינם פתוגניים. החרמש הירוק מצביע על אתר כזה, שאפשר לנצלו לצורך פיתוח אנטיביוטיקה יעילה.
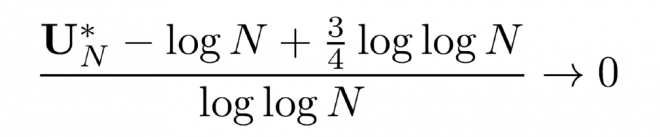
משפט זה מתאר את רמת השיא של שדה אקראי המוגדר על-ידי הפולינום האופייני של תבנית אקראית. המשפט מתאר - במקרה פרטי - תופעה העומדת במוקד המחקר של פרופ' עופר זיתוני ושותפיו למחקר, והיא: התנהגות השיאים של שדות אקראיים בעלי קורלציה לוגריתמית היא אוניברסלית, ואינה תלויה בפרטי השדה או בהיותו נורמלי (גאוסי).
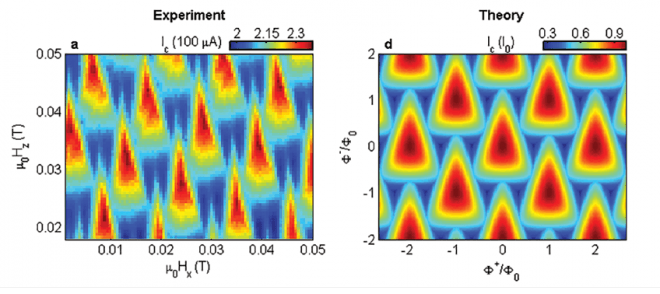
התקנים מוליכי-על להתאבכות קוונטית (SQUID) יכולים לשמש חישנים בעלי רגישות גבוהה ביותר לאותות מגנטיים חלשים. פרופ' אלי זלדוב ושותפיו למחקר פיתחו התקן כזה, אשר מסוגל למדוד בעת ובעונה אחת שני רכיבים ניצבים של שדה מגנטי, ומאפשר מיפוי של זרמים חשמליים חלשים ומדידת שדה מגנטי של עצמים מבודדים בגדלים ננו-מטריים. בתמונה נראית התאמה בין הניבוי התיאורטי (מימין) לבין תוצאות הניסוי שבוצע (משמאל) בדפוסי התאבכות הזרם החשמלי דרך החישן.
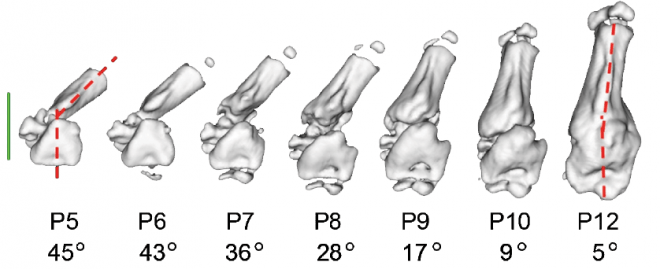
על-פי הדעה הרווחת, איחוי תקין של שבר תלוי בכך שהעצמות יהיו מיושרות זו אל זו. פרופ' אלי זלצר ושותפיו למחקר הראו, שבעצמות צעירות קיים מנגנון יישור אשר פועל דומה למגבה ("ג'ק"): כאשר הקצוות השבורים של עצמות רגל עכבר היו במיקומים לא מתאימים (ואפילו במיקום שונה לחלוטין מהנחוץ), נוצרו כוחות מכאניים אשר גרמו להתיישרות העצמות חזרה למקומן הנכון.
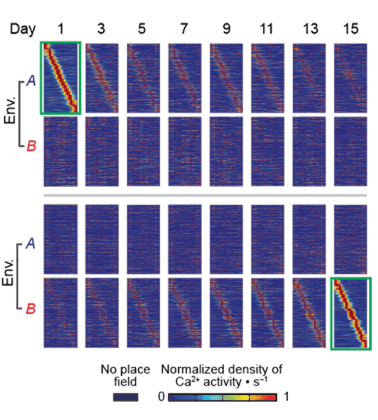
אנו חווים סביבות מוּכרות באופן שמשתנה במשך הזמן. ד"ר יניב זיו ושותפיו למחקר גילו "חותמות זמן" – דפוסי פעילות עצבית אשר משייכים נקודת זמן מסוימת לכל פעילות. דפוסים אלה, אשר נצפו במוחותיהם של עכברים במשך תקופה של שבועות, משתנים בהדרגה, כך שבנפרד מההקשר המרחבי, נמצא דמיון רב בין חותמות זמן של זמנים קרובים. ממצאים אלה מצביעים על כך, שייתכן כי קיים מנגנון שבאמצעותו יוצר המוח את ציר הזמן בזיכרון, ומבצע קישור או הפרדה בין אירועים על-פי הזמן שמפריד ביניהם.

תמונת השער בגיליון מארס 2019 של כתב-העת המדעי Nature Microbiology לקוחה מתוך מחקר של פרופ' אסף ורדי ותלמיד המחקר שלו גיא שלייר מהמחלקה למדעי הצמח והסביבה של מכון ויצמן למדע. המדענים שילבו במחקר בין שיטה מיקרוביולוגית קלאסית לכִּמּוּת נגיפים באמצעות מדידת "הרובד הנגיפי" (אזורים של תאים מתים המכונים פלאק) ושיטות עדכניות של דימות ספקטרומטריית מסות, ופיתחו גישה חדשה המאפשרת לעקוב אחר הפרופיל המטבולי שנוצר במהלך ההדבקה של האצה החד-תאית Emiliania huxleyi בנגיף EhV. זיהום נגיפי זה הוא בין הגורמים המרכזיים לקריסתן של פריחות הענק באוקיינוס הממלאות תפקיד מרכזי במחזורי הפחמן והגופרית במערכת האקולוגית הימית.
באמצעות הגישה החדשה, הצליחו המדענים לייצר מפות צבע הממחישות את השינוי בכמות של מטבוליטים שונים בזמן ההדבקה בנגיף. הם בחנו במיוחד את השינוי בזמינות ליפידים שממלאים ככל הנראה תפקיד מרכזי בקשרי הגומלין בין הנגיף לתא המארח. כפי שאפשר להבחין בתמונת השער, לכל אחד מהליפידים דפוס שונה של פיזור מרחבי שיכול להעיד על מצבי הדבקה שונים.
הגישה החדשנית שפיתחו המדענים עשויה לשמש בעתיד גם במערכות מודל אחרות, ובכלל זאת בחקר מחלות נגיפיות הפוגעות בבני אדם.
עוד על המחקר, בטור "מאחורי הקלעים" שכתבו המדענים