הסובלנות משתלמת. כך, למשל, לו יכולנו לשכנע את המערכת החיסונית להיות סובלנית כלפי רקמות זרות במקום לדחות אותן ללא רחמים, ניתן היה לטפל במיגוון מחלות דם באמצעות השתלת לשד עצם. בעזרת סובלנות חיסונית אפשר היה לבצע השתלות כאלה גם בבני-אדם שכעת מוגדרים כחלשים מכדי לקבל אותן. בנוסף, סובלנות מסוג זה עשויה להקל רבות על חולים בהם מושתלים כליות, כבד ואיברים אחרים.
צוות חוקרים, בראשות מדעני מכון ויצמן למדע, הצליח באחרונה ליצור רמה מסוימת של סובלנות חיסונית תוך שימוש בתאים חיסוניים טבעיים המכונים "תאי וטו". תאים אלה מפעילים כוח וטו כדי להגן על עצמם: כאשר הם מותקפים על-ידי התאים של המושתל, הם יוצאים להתקפה מקדימה ומשמידים את התוקפים.
ראש קבוצת המחקר,
פרופ' יאיר רייזנר מהמחלקה לאימונולוגיה במכון ויצמן למדע, חוקר תאי וטו זה כעשור, במיוחד את תאי ה-T החיסוניים מסוג +CD8. לתאים אלה יש יכולת הווטו הגבוהה ביותר, אך הם עלולים לגרום לסיבוך הקרוי מחלת השתל נגד המושתל, בה תוקף השתל את גופו של המושתל. הקבוצה של פרופ' רייזנר הצליחה למצוא דרך לעקוף בעיה זו באמצעות תאי וטו +CD8 מתונים יותר.
במחקר החדש, אשר פורסם בכתב-העת המדעי Blood, מדווחים פרופ' רייזנר ועמיתיו על כך שהצליחו להכין את הקרקע לשימוש בתאי וטו בבני-אדם. במאמר המערכת מבשר העיתון, שהמחקר גילה את התנאים "בהם ניתן יהיה ליישם לבסוף את ההבטחה של תאי וטו בתרפיית תאים".
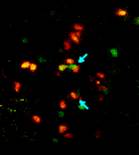
ואכן, במחקר גילו המדענים את המיקום המדויק בו מבצעים תאי הווטו את הפעילות ההגנתית שלהם: בקשרי הלימפה. המדענים גילו גם את מנגנון פעילות התאים. מתברר, כי הם מפעילים את זכות הווטו שלהם ברגע שתאי ה-T של המושתל, אשר סורקים את הגוף באופן שוטף בחיפוש אחרי פולשים זרים, מזהים את התאים המושתלים החדשים ומתחברים אליהם. אז בדיוק יוצאים תאי הווטו לפעולת המנע שלהם: הם משחררים רעלים זמינים והורגים את תוקפיהם – אשר זקוקים לזמן רב יותר כדי להכין את הרעלים שלהם עצמם. פרטים אלה התגלו במהלך מחקר שהתבצע בשיתוף עם מעבדתו של ד"ר גיא שחר מאותה מחלקה, אשר נעשה באמצעות מיקרוסקופ דו-פוטוני חדשני, המאפשר לעקוב אחרי תאים חיסוניים בודדים בגוף עכבר חי בזמן אמת.
בנוסף גילו המדענים כיצד לוודא כי תאי וטו אכן מגיעים ליעדם: לפני ההשתלה יש לגדל אותם בתרבית בעזרת חומר ביולוגי בשם אינטרלויקין-15, המשמר את הקולטנים אשר מובילים את התאים לקשרי הלימפה.
במחקר הנוכחי, תאי הווטו אכן השמידו בהצלחה את תאי ה-T של המושתל, האחראיים במידה רבה לדחיית השתל. כתוצאה מכך, עכברים לבנים קיבלו ב"סובלנות" שתל עור מעכבר שחור. בדרך כלל, כדי לבצע השתלת עור מסוג זה נדרש דיכוי קיצוני של המערכת החיסונית של המושתל באמצעות תרופות והקרנות, כדי למנוע דחייה. הודות לסובלנות החיסונית שהוקנתה על-ידי תאי הווטו, העכברים הלבנים לא דחו את הטלאים השחורים, למרות שהמערכת החיסונית שלהם דוכאה באופן חלקי בלבד. דרוש כמובן מחקר נוסף כדי לקבוע האם גישה זו תהיה יעילה בבני-אדם באותה מידה כמו בעכברים.
חלק רב וחשוב במחקר זה, שנעשה במעבדתו של פרופ' רייזנר, תרמו תלמיד המחקר (דאז) ד"ר ערן אופיר ותלמידת המחקר נגה אור-גבה. ד"ר אופיר וד"ר יקי אדלשטיין (כחלק מעבודת הדוקטורט שלו) תרמו במשותף למחקר קודם במעבדתו של פרופ' רייזנר, שהתפרסם בכתב-העת Blood בשנת 2010, בו פיתחו המדענים את עקרונות השימוש בתאי וטו בעכברים במערכת מלאכותית יותר, המדמה את דחיית שתל לשד העצם.
נכון לעכשיו מתבצעות השתלות לשד העצם אך ורק לצורך ריפוי מחלות קטלניות, משום שההשתלות עצמן מהוות סכנת חיים. הסכנה הגדולה ביותר היא הדבקה בזיהומים, כתוצאה מדיכוי המערכת החיסונית המתבצע כהכנה להשתלה. אך אם הדיכוי יהיה חלקי בלבד, כפי שנעשה במחקר הנוכחי, אפשר יהיה לבצע השתלות גם במחלות לא קטלניות, כמו תלסמיה ואנמיה חרמשית. כמו כן, אפשר יהיה לבצע השתלות בחולים שכיום אינם יכולים לקבל טיפול זה, מפני שהם חלשים מכדי לעמוד בדיכוי מאסיבי של המערכת החיסונית – כמו חולים קשישים בלוקמיה או בלימפומה. יתר על כן, הצלחת החוקרים להשתיל רקמת עור זרה מלמדת, כי תאי וטו עשויים ליצור סובלנות גם כלפי השתלת כליות או איברים אחרים, דבר שימנע את הצורך בדיכוי מתמשך של המערכת החיסונית של המושתל.
הגנום השני
אישי
ערן נשוי להילה, רופאה בכירה, מנהלת המרכז לרפואת איידס בבית החולים "הדסה". לזוג תאומים בני 13, שירה ועמרי, וילדה בת 8, ענבל. את זמנו הפנוי הוא מקדיש לספורט ימי, לרכיבה על אופניים ולטיולים.