
ד"ר אידה רישל ופרופ' מייק פיינזילבר מהמחלקה לכימיה ביולוגית במכון, ביחד עם עמיתיהם, סיפקו באחרונה את התשובה עבור תאים גדולים – כמו תאי עצב. ממצאים אלה עשויים גם לקדם את יכולתנו להאיץ את שיקומם של תאי עצב פגועים.
פרופ' פיינזילבר וד"ר רישל, יחד עם ד"ר נעמן קם ורותם בן-טוב פרי מהמחלקה לכימיה ביולוגית, ד"ר ורה שינדר מהמחלקה לתשתיות למחקר כימי, פרופ' אליזבת פישר מהיוניברסיטי קולג' בלונדון, ופרופ' ג'יאמפייטרו סקיאבו מהמכון לחקר הסרטן בלונדון, סברו כי ייתכן שהפתרון לשאלה טמון ב"מערכת ההסעה" אשר חוצה את תא העצב לכל אורכו, ומובילה אותות ומטענים לאורך התא. המערכת כוללת "מסילה" הבנויה מצינוריות זעירות, ושני סוגים של מנועים הנעים לאורכן: סוג אחד, קינזין, נע אך ורק ממרכז התא אל קצה האקסון, ואילו הסוג האחר, דיינין, נע בכיוון ההפוך, מקצה האקסון אל מרכז התא. האם התא מנצל את האותות הנישאים על המנועים האלה כדי למדוד את אורכו?
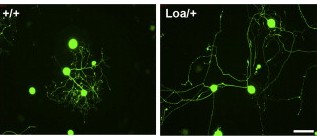
בשלב הראשון יצרו המדענים מודלים ממוחשבים, אשר מתארים מנגנונים אפשריים שבאמצעותם עשויים המנועים התאיים למדוד את המרחק שהם עוברים. לפי מודל אחד, מנועי הדיינין, הנעים לכיוון מרכז התא, משחררים בהדרגה אותותכמו פיזור פרורי לחם לאורך השביל במרחקים קבועים. כמות האותות שנותרה ברשותם בסוף המסלול תאפשר לגלות את המרחק שעברו. לפי מודל זה, הפחתת מספר מנועי הדיינין תוביל לירידה במספר האותות שנותרו בסוף המסלול, ולכן תגרום להערכת יתר של אורך התא. כתוצאה מכך יואט קצב גידול השלוחות, ובסופו של תהליך הצמיחה הן יהיו קצרות יותר.
המודל השני מבוסס על לולאת משוב בין שני סוגי המנועים. כאשר האות הנשלח מאחד המנועים מגיע לסוף הקו, הוא מפעיל איתות נוסף הנשלח בחזרה על-ידי המנוע השני, ומעכב בהגעתו את משלוח האות המקורי, וחוזר חלילה. במקרה זה, מדידת האורך מבוססת על תזמון, או, ליתר דיוק, על שכיחות קליטת האותות בנקודות הקצה. אפשר לדמות את המנגנון למשחק פינג-פונג: כאשר משחקים על שטח קטן, קרוב לרשת, יהיו המכות מהירות יותר. לעומת זאת, משחק מקצות השולחן יוביל להפסקות ממושכות יותר בין מכת מחבט אחת לשנייה. בניגוד למודל הראשון, במקרה זה, הפחתה בכמות של אחד המנועים תגרום דווקא לצמיחה מהירה יותר וליצירת שלוחות ארוכות יותר, משום שתדירות האותות תפחת בקצב איטי יותר.
בשלב השני ביצעו המדענים ניסויים, תחילה בתרביות תאים ולאחר מכן בעכברים, בהם הפחיתו את כמות הדיינין. בשני המקרים צמחו השלוחות לאורך גדול מהרגיל, וכך שללו את נכונות המודל הראשון, וחיזקו את נכונות המודל השני.
בשלב האחרון ביקשו המדענים לבדוק אם המנגנון ייחודי לתאי עצב, או שאולי תאים גדולים נוספים משתמשים בשיטות דומות כדי למדוד את גודלם, וחזרו על הניסוי בתאי רקמת חיבור – הקרויים פיברובלסטים. גם במקרה זה מצאו המדענים עדויות לשימוש באותו מנגנון, המבוסס על תדירות האותות.
הממצאים לא רק מספקים הסבר אפשרי למיסתורין ארוך שנים - כיצד מעריכים תאים גדולים את גודלם, אלא הם גם בעלי משמעות למחקר על התחדשות תאי עצב. תאי עצב השייכים למערכת העצבים ההיקפית מסוגלים אמנם לצמוח מחדש לאחר פגיעה, אך מדובר בתהליך איטי ביותר, ולעיתים נדרשות שנים עד לחזרתם לגודל המקורי. חלק מהסיבה לכך היא, שברגע שתא עצב מגיע ליעדו – דבר שקורה בדרך כלל במהלך ההתפתחות העוברית – הוא מפסיק לצמוח ולהתארך מהקצה, ובמקום זאת גדל באמצעות התמתחות לכל אורכו. הבנת האותות המדויקים בהם משתמש התא לא רק כדי למדוד את עצמו, אלא גם כדי לכוון את גדילתו בהתאם, עשויה להצביע על כיוונים חדשים להאצת ההתחדשות של תאי עצב.
בחזרה לעתיד
ההבדל בין תאים בוגרים וממוינים לבין תאי גזע מבוסס על העיקרון האחראי לשונות בין כל תאי הגוף: למרות שהם מכילים בדיוק אותם גנים, התאים נבדלים זה מזה במידה, באופן ובתזמון בהם גנים אלה מתבטאים – כלומר, הופכים לחלבון. ההבדלים בביטוי נובעים מהאופן בו ארוז החומר הגנטי: בכל אחד מהתאים, בהתאם לסוגו לתיפקוד שלו, גנים מסוימים חשופים – ולכן יכולים להתבטא, ואילו גנים אחרים ארוזים היטב, ולא נעשה בהם שימוש. במהלך התיכנות מחדש נעשה שינוי כולל באריזת החומר הגנטי: גנים מסוימים נארזים ומשתתקים, וגנים אחרים נחשפים.
כדי לגלות כיצד מתחוללים שינויי האריזה יצר צוות המדענים, שכלל את עמיתת המחקר ד"ר נועה נוברשטרן, החוקר הבתר-דוקטוריאלי ד"ר עבד אלפתח מנסור, ואוהד גפני, אשר מבצע פרויקט מחקר במעבדה, מוטציות אקראיות בתאים, והחדיר לתוכם את ארבעת הגנים האחראים לתיכנות מחדש. לאחר מכן נבדקו התאים שבהם לא צלח התהליך, במטרה לזהות את המוטציה שאחראית לכישלון. כך הצליחו לגלות אנזים שפעילותו חיונית לאריזה מחדש של החומר הגנטי. האנזים, הקרוי Utx, מופעל על-ידי ארבעת הגנים המוחדרים לתא, ועובד במשותף איתם. ביחד, הם פותחים את מולקולות הדי-אן-אי, חושפים את מאות הגנים של התוכנית העוברית התאית, ומאפשרים ביטוי שלהם – וזאת למרות שבתא הבוגר הנורמלי ארוזים הגנים האלה ומושתקים בחוזקה.
ברור כי האנזים Utx נוצר לא רק כדי שיום אחד יוכלו מדענים לייצר תאי גזע מושרים. כדי לגלות את תפקידו הטבעי, יצרו המדענים עכברים מהונדסים, שאינם מייצרים את האנזים. להפתעתם, עכברים אלה היו עקרים. בהמשך התגלתה הסיבה לעקרות: מתברר, כי האנזים Utx חיוני ליצירת תאי המין, כלומר תאי זרע או תאי ביצית, בעובר המתפתח. לדברי ד"ר חנא, ממצא זה אינו מפתיע מאוד, שכן גם במקרה זה מדובר במעין מסע התפתחותי לעבר: "בשלב מסוים של ההתפתחות, תאים עובריים מסוימים, שכבר עברו מספר ימים של התמיינות, צריכים 'לסגת' מההתפתחות שלהם, ולהפוך לתאי גזע – תאי מין. התוכנית הגנטית של תאי המין האלה דומה מאוד לזו של תאי הגזע המושרים, ובשני המקרים האנזים Utx הוא שסולל את הדרך לנסיגה ההתפתחותית הזו". עקב סיבה זו, ממצאי המחקר עשויים להיות רלבנטיים גם להבנת בעיות פוריות ולטיפול בהן.
מחקר מפורט של תהליך התיכנות מחדש, תוך זיהוי נקודות המפתח, ומקומות מועדים לשיבושים, יאפשר לשפר את שיעורי ההצלחה, ולייצר תאי גזע טובים יותר – וכך יקדם את השימוש בתאי גזע מושרים במיגוון מטרות רפואיות ומחקריות. בנוסף, הוא יפתח צוהר להבנת תהליכי התפתחות מוקדמים. ד"ר חנא: "במחקר הזה הצלחנו לאתר צומת התפתחותי חשוב וספציפי, אחד מני רבים, בו נוצרים תאי המין. השינויים בעובר, בעיקר בשלבים המוקדמים של ההתפתחות, הם מהירים ודרמטיים, וקשה מאוד לחקור אותם, כי חלון ההזדמנויות הוא קצר מאוד. אנחנו שואפים לפצח את החלונות האלה בזה אחר זה".